ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
Электролитическая диссоциация – это процесс распада молекул вещества на ионы под действием полярных молекул растворителя, а также при расплаве этих веществ. Следствием электролитической диссоциации является электрическая проводимость растворов и расплавов электролитов (кислот, оснований, солей). Электролитическая диссоциация – процесс обратимый, и в растворах электролитов имеет место равновесие между ионами и молекулами. Отношение числа молекул, распавшихся на ионы (Ni), к общему числу растворенных молекул (N) электролита называется степенью диссоциации a: a = N1/ N. Степень диссоциации зависит от природы электролита, его концентрации, природы растворителя, присутствия в растворе одноименных ионов. Степень диссоциации электролита определяется экспериментально и выражается в долях единицы или в процентах. По степени диссоциации электролиты делятся на сильные, средние и слабые. К сильным электролитам относятся такие, которые в 0, 1 М растворе имеют α > 30%. Сильными электролитами являются: 1) почти все соли (кроме HgCl2, CdCl2, Fe(SCN)3, Pb(CH3COO)2 и некоторых других); 2) многие минеральные кислоты, например HNO3, HC1, H2SO4, HI, HBr, HC1O4 и др.; 3) основания щелочных и щелочно-земельных металлов, например КОН, NaOH, Ba(OH)2 и др. У средних электролитов α = 3 – 30% в 0, 1 М растворах; к ним относятся, например, Н3РО4, H2SO3, HF, Mg(OH)2. Для слабых электролитов в 0, 1 М растворах α < 3%; слабыми электролитами являются H2S, H2CO3, HNO2, HCN, H2SiO3, H3BO3, HC1O и другие, а также большинство оснований многовалентных металлов, NH4OH и вода. В табл. 1 приведены примеры электролитов различной силы и даны примеры записи уравнений их диссоциации. Об относительной силе электролитов можно судить по электрической проводимости их растворов. При разбавлении растворов электролитическая диссоциация α увеличивается. Присутствие в растворе одноименных ионов понижает степень диссоциации.
Таблица 1 Сильные и слабые электролиты
Многоосновные кислоты и многокислотные основания диссоциируют ступенчато. Например:
Ступенчатость диссоциации обусловливает возможность Кроме степени диссоциации состояние слабых электролитов в растворе характеризует константа равновесия между молекулами и ионами. Например, для азотистой кислоты HNO2 «H+ + NO2- K = где К – константа электролитической диссоциации, не зависящая ни от концентрации раствора электролита, ни от присутствия в растворе других электролитов. Константа электролитической диссоциации дает более общую характеристику электролита, чем степень диссоциации. Константа диссоциации зависит от температуры и природы растворителя. Между константой и степенью диссоциации слабого электролита существует взаимосвязь: К = a2× с/(1– a). (14) Это уравнение – математическое выражение закона разбавления Оствальда. Для слабого электролита при небольших разбавлениях a очень мала, а величина (1 – a) близка к единице, поэтому К = с× a2, или a = Смещение ионного равновесия, которое приводит к увеличению или уменьшению степени диссоциации слабого электролита, осуществляется по принципу Ле Шателье. Введение в раствор одноименного иона, то есть увеличение концентрации одного из продуктов реакции, приводит к смещению ионного равновесия влево, в сторону образования молекул или к уменьшению степени диссоциации слабого электролита. Наоборот, связывание одного из ионов в малодиссоциированное вещество ведет к повышению степени диссоциации электролита.
|


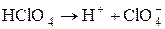

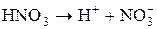
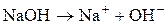
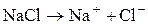
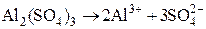
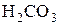 «
«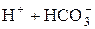 (I ступень);
(I ступень);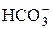 «
«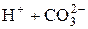 (II ступень);
(II ступень);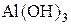 «
«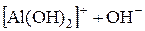 (I ступень);
(I ступень);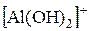 «
«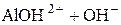 (II ступень);
(II ступень);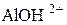 «Al3++OH− (III ступень).
«Al3++OH− (III ступень).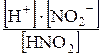 ,
,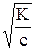 .
.


