ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ. Вода – малодиссоциированное вещество
Вода – малодиссоциированное вещество. Константа диссоциации воды равна К = Молярная концентрация воды [Н2О]составляет 55, 5 моль/л, откуда ионное произведение воды (или постоянная воды) Кв = [Н+][0Н] = 1, 8 • 10-16 • 55, 5 = 10-14 (при 22 °С). Концентрации ионов Н+ и ОН- в нейтральном растворе равны между собой: [Н+] = [ОН-] = Однако при добавлении к воде кислоты или щелочи ионное равновесие будет смещено влево (вспомнить действие одноименного иона на степень диссоциации слабого электролита). Количественно характер среды раствора определяется водородным показателем рН, который вычисляется через отрицательный десятичный логарифм от концентрации ионов водорода: рН = –lg [H+]. Для нейтральных растворов рН равен 7, для кислых он меньше 7, а для щелочных – больше 7. Характер среды раствора приблизительно можно определять с помощью кислотно-основных индикаторов, меняющих свой цвет в зависимости от концентрации ионов водорода или гидроксид-ионов. Каждый индикатор характеризуется определенными интервалами рН раствора, при которых он изменяет свой цвет. В табл. 3 приведены интервалы наиболее употребительных индикаторов. Таблица 3 Интервалы значений рН основных индикаторов
Изменение цвета лакмуса от красного до синего происходит при рН от 5 до 8, метилового оранжевого – от розового до желтого – при рН от 3, 1 до 4, 4, фенолфталеина – от бесцветного до малинового – при рН от 8, 3 до 9, 8. Эти интервалы значений рН называются областями перехода индикатора. Для установления рН среды пользуются также универсальным индикатором, составленным из специально подобранных веществ. Более точно рН раствора измеряется с помощью электрического прибора рН-метра (потенциометра).
|

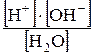 = 1, 8 • 10-16 (при 22 °С).
= 1, 8 • 10-16 (при 22 °С). -14 = 10 -7 моль/л.
-14 = 10 -7 моль/л.


