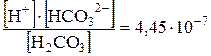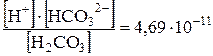Примеры решения типовых задач
Пример 1. Концентрация ионов водорода в растворе равна10-3 моль/л. Определите рН раствора. Решение. рН = –lg[10-3] = 3. Пример 2. Определите концентрацию ионов водорода в растворе, рН которого равен 4, 6. Решение. –lg [H+] = 4, 6; следовательно lg [H+] = –4, 6; [H+]=2, 5 ∙ 10-5 (расчеты вести, используя калькулятор). Пример 3. Чему равнаконцентрация гидроксид-ионов в растворе, рН которого равен 10, 80? Решение. Изсоотношения рН + рОН = 14 находим: рОН = 14 – рН = 14 – 10, 80 =3, 20 отсюда –lg [ОH-] =3, 20; lg [ОH-]= –3, 20 [ОH-] =6, 31∙ 10-4 моль/л. Пример 4. Определите концентрации HCO3- и СО32- в 0, 04 М растворе угольной кислоты, если рН этого раствора равен 4, 18. Решение. Найдем концентрацию ионов водорода в растворе: –lg[Н+] = 4, 18; lg[H+] = –4, 18; [Н+] = 6, 61 · 10-5 моль/л Теперь, воспользовавшись данными прил. Ж, запишем выражение для константы диссоциации угольной кислоты по первой ступени: K1 = Подставляя значения [Н+] и [Н2С03], находим: [НСОз-]=4, 45 ·10-7·10-2/(6, 61·10-5) = 6, 73·10-5 моль/л Аналогично записываем выражение для константы диссоциаций Н2С03 по второй ступени и находим значение [CO32-]: K2 = [CO32-]= 4, 69·10-11·6, 73·10-5/(6, 61·10-5) = 4, 8·10-11 моль/л.
Контрольные вопросы и задачи для самостоятельной работы 1. Может ли в водном растворе концентрация [Н+] или [ОН-] равняться нулю? 2. Вычислите концентрацию [ОН-] при рН 4, 7. 3. Найдите молярную концентрацию ионов Н+ в водных растворах, в которых концентрация гидроксид-ионов (моль/л) составляет: а) 10-4; б) 3, 2·10-6; в) 7, 4·10-11. 4. Найдите молярную концентрацию ионов ОН- в водных растворах, в которых концентрация ионов водорода (моль/л) равна: а) 10-3; б) 6, 5·10-8; в) 1, 4·10-12. 5. Вычислите рН растворов, в которых концентрация ионов Н+ (моль/л) равна: а) 2·10-7; б) 8, 1·10-3; в) 2, 7·10-10. 6. Вычислите рН растворов, в которых концентрация ионов ОН- (моль/л) равна: а) 4, 6·10-4; б) 5·10-6; в) 9, 3·10-9. 7. Вычислите рН 0, 01 н раствора уксусной кислоты, в котором степень диссоциации кислоты равна 0, 042. 8. Определите рН раствора, в 1 л которого содержится 0, 1 г NaOH. Диссоциацию щелочи считать полной. 9. Определите [Н+] и [ОН-] в растворе, рН которого равен 6, 2. 10. Вычислите рН следующих растворов слабых электролитов: а) 0, 1М НСN; б) 0, 02М NH4OH; в) 0, 05н НСООН; г) 0, 01М СН3СООН. 11. Чему равна концентрация раствора уксусной кислоты, рН которого равен 5, 2? 12. Степень диссоциации слабой одноосновной кислоты в 0, 2 н растворе равна 0, 03. Вычислите значения [Н+], [ОН-] и pOН для этого раствора. 13. Укажите, какие из рядов перечисленных ниже кислот соответствуют возрастанию рН в растворах одинаковой молярной концентрации a) HCN, HF, HOC1, НСООН, СН2С1СООН; б) HN03, HN02, CH3COOH, HCN; в) НС1, СН2С1СООН, HF, Н3В03. 14. В 0, 01 н. растворе одноосновной кислоты рН = 4. Какое утверждение о силе этой кислоты правильно: а) кислота слабая; б) кислота сильная? 15. Как изменится кислотность 0, 2 н раствора HCN при введении в него 0, 5 моль/л KCN: а) возрастет; б) уменьшится; в) не изменится? 16. Как надо изменить концентрацию ионов водорода в растворе, чтобы рН раствора увеличился на единицу: а) увеличить в 10 раз; б) увеличить на 1 моль/л; в) уменьшить в 10 раз; г) уменьшить на 1 моль/л? 17. Сколько ионов водорода содержится в 1 мл раствора, рН которого равен 13: а) 1013; б) 60, 2·1013; в) 6, 02 ·107; г) 6, 02·1010? 18. Как изменится рН воды, если к 10 л ее добавить 10-2 моль NaOH: а) возрастет на 2; б) возрастет на 3; в) возрастет на 4; г) уменьшится на 4?
|