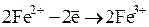Восстановления
Для количественного расчета возможности протекания ОВР используют значения окислительно-восстановительных потенциалов (редокс-потенциалов) каждой полуреакции (в прил. И приводятся их стандартные значения). Стандартным окислительно-восстановительным потенциалом называется энергия полуреакции, измеренная по отношению к стандартному водородному электроду. Чем меньше алгебраическая величина редокс-потенциала, тем больше восстановительная способность полуреакции, и, наоборот, чем больше алгебраическая величина, тем активнее окислительная функция полуреакции. Возможность протекания окислительно-восстановительных процессов зависит не только от природы реагирующих веществ, но и от их концентрации, температуры, рН среды. Все эти факторы количественных расчетов учитываются универсальным уравнением Нернста:
где E- окислительно-восстановительный потенциал сопряженной пары; E0– стандартный окислительно-восстановительный потенциал; R– молярная газовая постоянная, равная 8, 314 Дж/(моль • К); T– температура, К; п – число электронов, участвующих в реакции; F– постоянная Фарадея, равная 96 500 Кл; аок форма –активность окисленной формы в системе; авос.форма – активность восстановленной формы в системе (в разбавленных растворах вместо активности берут концентрации). Если в формулу Нернста подставить значения констант, перевести натуральный логарифм в десятичный и вместо активностей использовать концентрации, то уравнение для расчетов Eпри 298 К (25 °С) примет вид
Для сложных ионов, претерпевающих изменение в составе, редокс-потенциал зависит от рН среды. Например, для пары
Реакция окисления-восстановления осуществляется в том направлении, в котором разность потенциалов окислителя и восстановителя (ЭДС) будет величиной положительной (∆ E=Eок - Eвос > 0). В каждой окислительно-восстановительной паре различают окисленную форму (Ох), образованную элементом, находящимся в более высокой степени окисления ( Величины окислительно-восстановительных потенциалов (редокс-потенциалов) определяются природой раствора, соотношением концентрации окисленной и восстановленной форм и температурой. Эта зависимость количественно отражается уравнением Нернста, которое для редокс-систем имеет вид
где Подставляя в уравнение Нернста значения констант и переходя от натуральных логарифмов к десятичным, получаем
При С окисл. = С восст. = I моль/л Влияние концентрации реагирующих веществ на величину окислительно-восстановительного потенциала видно из следующего примера. Если, например, увеличить концентрацию ионов
Стандартный окислительно-восстановительный потенциал На величину окислительно-восстановительного потенциала влияет концентрация ионов водорода. С увеличением концентрации ионов Из прил. И следует, что редокс-потенциал кислорода в сильнокислой среде Окислительно-восстановительные потенциалы количественно характеризуют окислительные свойства окислителя (окисленной формы) и восстановительные свойства восстановителя (восстановленной формы). Чем больше абсолютная величина окислительно-восстановительного потенциала, тем сильнее окислительные свойства окисленной формы и тем слабее восстановительные свойства восстановленной формы. Сопоставляя окислительно-восстановительные потенциалы, можно сравнить окислительные или восстановительные свойства различных веществ. Например, рассмотрим, как изменяются окислительные свойства галогенов в ряду Из значений окислительно-восстановительных потенциалов следует, что в ряду В ряду Сравнивая величины стандартных окислительно-восстановительных потенциалов участвующих веществ, можно сделать заключение о возможности самопроизвольного протекания окислительно-восстановительной реакции при условиях, близких к стандартным. Зная окислительно-восстановительные потенциалы, можно определить ЭДС реакции:
где Пример 13. Определить, в каком направлении пойдет следующая реакция:
Na2SO3 + HNO3 «Na2SO4 + NO + H2O. Найдем (прил.И) окислительно-восстановительные потенциалы и рассчитаем ЭДС реакции:
Окислителем здесь может быть только HNO3, так как
Реакция протекает в прямом направлении, т.е. происходят следующие окислительно-восстановительные процессы:
3| 2| _________________________
3Na2SO3 + 2HNO3 = 3Na2SO4 + 2NO + H2O.
Пример 14. Определить, будут ли перманганат-ионы окислять хлорид-ионы до свободного хлора в кислой и нейтральной средах. Найдем в прил. И окислительно-восстановительные потенциалы:
В кислой среде окислительно-восстановительный потенциал перманганат-иона больше, чем В нейтральной среде окислительно-восстановительный потенциал системы с участием перманганат-ионов значительно меньше, чем Пример 15. Определить, какой из металлов – барий или никель будет более интенсивно взаимодействовать с разбавленной соляной кислотой. Составляем уравнения реакций:
Находим потенциалы пар и определяем ЭДС для первой и второй реакции
Электродвижущая сила первой реакции значительно больше, чем второй. Следовательно, барий будет взаимодействовать с соляной кислотой Можно сделать вывод, что из всех возможных при данных условиях в первую очередь протекает та окислительно-восстановительная реакция, которая имеет наибольшую разность окислительно-восстановительных потенциалов. Пример 16. Можно ли ион Составляем ионно-электронные полуреакции для процессов окисления и восстановления:
В прил. И находим потенциалы пар:
Следовательно, ион Рассмотренные правила применимы не только для пространственно разделенных полуреакций, но и тогда, когда взаимодействие осуществляется в одном растворе. Таким образом, окислительно-восстановительные потенциалы позволяют количественно оценить активность окислителя и восстановителя, направление и интенсивность протекания окислительно-восстановительной реакции. При изучении окислительно-восстановительных реакций часто необходимо знать, насколько сильно смещается вправо равновесие обратимого процесса:
Red¢ +Ox «Red +Ox¢ Степень протекания реакции слева направо определяется константой равновесия. Константа равновесия для любых окислительно-восстановительных процессов может быть вычислена, если известны окислительно-восстановительные потенциалы окислителя и восстановителя. Константа равновесия связана с окислительно-восстановительными потенциалами следующим соотношением:
где К – константа равновесия реакции; Зная константу равновесия, можно, не прибегая к опытным данным, рассчитать, насколько полно протекает реакция. Большая величина константы показывает, что равновесие реакции сдвинуто почти целиком слева направо (в прямом направлении). Малая величина константы показывает, что равновесие реакции практически полностью сдвинуто в сторону исходных веществ. Найдем константу равновесия для реакции: +2 +6 +3 +3
3 | 1 | _____________________
Находим (прил. И) окислительно-восстановительные потенциалы пар:
Вычисляем константу равновесия для рассматриваемой реакции (в окислительно-восстановительном процессе участвуют 6 электронов)
Число 1060 означает, что равновесие в рассматриваемой системе наступит тогда, когда произведение концентрации ионов исходных продуктов будет в 1060 раз меньше произведения концентраций ионов конечных продуктов. Следовательно, данная реакция протекает практически необратимо, т.е. на 100% слева направо.
|






 ), и восстановленную форму (Red), образованную ионами более низкой степени окисления (
), и восстановленную форму (Red), образованную ионами более низкой степени окисления ( ). Разность потенциалов на границе между инертным электродом и раствором, содержащим окисленную и воcстановленную формы вещества, называют окислительно-восстановительным потенциалом.
). Разность потенциалов на границе между инертным электродом и раствором, содержащим окисленную и воcстановленную формы вещества, называют окислительно-восстановительным потенциалом. ,
, – окислительно-восстановительный потенциал, В; Ох (С окисл.) – концентрация (или, точнее, активность) окисленной формы; Red (С восст.) – концентрация (активность) восстановленной формы; R – газовая постоянная равная 8, 314 Дж/(моль× К); Т – абсолютная температура, К; F – число Фарадея, равное 96500 Кл/моль; n – число электронов, отдаваемых или получаемых при превращении восстановленной формы в окисленную (или обратно);
– окислительно-восстановительный потенциал, В; Ох (С окисл.) – концентрация (или, точнее, активность) окисленной формы; Red (С восст.) – концентрация (активность) восстановленной формы; R – газовая постоянная равная 8, 314 Дж/(моль× К); Т – абсолютная температура, К; F – число Фарадея, равное 96500 Кл/моль; n – число электронов, отдаваемых или получаемых при превращении восстановленной формы в окисленную (или обратно);  –нормальный или стандартный окислительно-восстановительный потенциал, измеренный по отношению к стандартному водородному электроду при С окисл. = С восст.= I моль/л.
–нормальный или стандартный окислительно-восстановительный потенциал, измеренный по отношению к стандартному водородному электроду при С окисл. = С восст.= I моль/л. .
. . Если С окисл. > С восст., редокс-потенциал становится более положительным по сравнений с
. Если С окисл. > С восст., редокс-потенциал становится более положительным по сравнений с  ).
). в 10 раз по сравнению с концентрацией
в 10 раз по сравнению с концентрацией  = I моль/л, то окислительно-восстановительный потенциал системы
= I моль/л, то окислительно-восстановительный потенциал системы  будет равен:
будет равен:
 Если концентрация ионов
Если концентрация ионов  в 100 раз больше концентрации
в 100 раз больше концентрации  окислительно-восстановительный потенциал пар, у которых окисленная форма содержит кислород (
окислительно-восстановительный потенциал пар, у которых окисленная форма содержит кислород ( и др.), возрастает, а при уменьшении концентрации ионов
и др.), возрастает, а при уменьшении концентрации ионов  падает.
падает. ,
,  в слабокислой
в слабокислой  а в щелочной
а в щелочной 
 и восстановительные свойства галогенид-ионов в ряду
и восстановительные свойства галогенид-ионов в ряду  , если их стандартные окислительно-восстановительные потенциалы следующие:
, если их стандартные окислительно-восстановительные потенциалы следующие: 


 окислительные свойства галогенов уменьшаются:
окислительные свойства галогенов уменьшаются:  .
. восстановительные свойства увеличиваются:
восстановительные свойства увеличиваются:  .
.
 - потенциал окислителя;
- потенциал окислителя;  - потенциал восстановителя.
- потенциал восстановителя.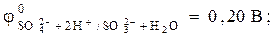



 о-е; в-ль
о-е; в-ль в-е; о-ль
в-е; о-ль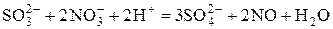
 (кислая среда);
(кислая среда); (нейтральная среда);
(нейтральная среда); .
. . Следовательно, в кислой среде перманганат-ионы будут окислять хлорид-ионы до свободного хлора.
. Следовательно, в кислой среде перманганат-ионы будут окислять хлорид-ионы до свободного хлора.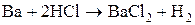 ;
; .
.


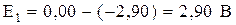 ;
; 
 окислить в
окислить в  в кислой среде, действуя ионом
в кислой среде, действуя ионом  , чтобы последний восстановился до
, чтобы последний восстановился до  ?
? о-е;
о-е; (18)
(18) (19)
(19) является более активным окислителем, чем ион
является более активным окислителем, чем ион  , и реакция невозможна. Если собрать гальваническую цепь из этих двух полуэлементов, то электроны будут переходить от второго полуэлемента (19) к первому полуэлементу (18), т.е. ион
, и реакция невозможна. Если собрать гальваническую цепь из этих двух полуэлементов, то электроны будут переходить от второго полуэлемента (19) к первому полуэлементу (18), т.е. ион  ;
; 
 и
и  – стандартные окислительно-восстановительные потенциалы окислителя и восстановителя; n – число электронов, принимаемых окислителем и отдаваемых восстановителем.
– стандартные окислительно-восстановительные потенциалы окислителя и восстановителя; n – число электронов, принимаемых окислителем и отдаваемых восстановителем.