ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Окислительно-восстановительными реакциями (ОВР) называются реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ. Состояние атомов в молекуле характеризует его степень окисления (окислительное число). Степень окисления – это условный заряд атома в молекуле, вычисленный исходя из предположения, что молекула состоит только из ионов. Степень окисления является формализованным отображением общей валентности элемента в соединении, определяемой суммой его ковалентности и электровалентности. Степень окисления может иметь положительное, отрицательное и нулевое значение. Атомы одного и того же элемента в различных соединениях проявляют различные значения степени окисления. Так, степени окисления углерода в молекулах СН4, СН3ОН, СН2О, НСООН, СО2 соответственно равны – 4, – 2, О, +2, +4, тогда как валентность углерода во всех этих соединениях равна четырем. Изменение степени окисления связано с переходом электронов или смещением электронных пар к наиболее электроотрицательному атому. Степень окисления можно рассчитать, пользуясь простыми правилами: – в простых веществах степень окисления элемента всегда равна нулю, например – постоянную степень окисления имеют щелочные элементы (+1); бериллий, магний, щелочноземельные элементы (+2), фтор (–1); – для водорода в большинстве соединений характерна степень окисления (+1), кроме гидридов активных металлов, например CH2, где степень окисления водорода равна –1; – степень окисления кислорода, как правило, равна –2; к важнейшим исключениям относятся пероксидные соединения, где она равна –1, и фторид кислорода OF2, в котором степень окисления кислорода равна +2; – степень окисления иона элемента равна заряду иона. Например, в соединении MnSO4 сульфат-ион имеет заряд –2, а ион марганца +2, следовательно степень окисления марганца +2; – для элементов с непостоянной степенью окисления её значение подсчитывают исходя из того, что молекула электронейтральна, т.е. сумма степеней окисления всех атомов в молекуле равна нулю. Пример 1. Вычислите степень окисления хрома в соединении K2Cr2O7. Калий имеет постоянную степень окисления +1, т.к. находится в I группе главной подгруппе; у кислорода степень окисления –2, степень окисления хрома обозначим через х. Составим алгебраическое уравнение: 2∙ (+1) + 2∙ х + 7∙ (–2) = 0; 2х = 14 – 2 = 12; х = +6 Следовательно, в соединении K2Cr2O7 хром имеет высшую степень окисления +6.
С электронной точки зрения окислением называется процесс потери электронов, а восстановлением — процесс, связанный с присоединением электронов. Вещества, которые при окислительно-восстановительных реакциях теряют электроны, называются восстановителями, а вещества, присоединяющие электроны, –окислителями. Итак, окислитель в процессе реакции всегда восстанавливается (степень окисления понижается), а восстановитель окисляется (степень окисления возрастает). Ниже схематически показано изменение степени окисления элементов при окислительно-восстановительных реакциях. Восстановление – присоединение электронов – уменьшение степени окисления;
-4 -3 -2 -1 0 +1 +2 +3 +4 +5 +6 +7 +8
окисление – отдача электронов – увеличение степени окисления. В окислительно-восстановительной реакции могут участвовать нейтральные атомы (молекулы), элементарные ионы и сложные. Типичными окислителями являются О2, О3, галогены (F2, Сl2, Вг2, I2), ионы металлов (Ag+, Au3+, Fe3+, Hg2+ и др.); вещества, содержащие в своем составе атомы в высших степенях окисления ( Типичными восстановителями являются почти все металлы и многие неметаллы (Н2, В, С и др.) в свободном состоянии; некоторые соединения, содержащие атомы с отрицательной степенью окисления ( Если же вещество содержит элемент в промежуточной степени окисления, то в зависимости от условий проведения реакции оно может быть и окислителем, и восстановителем (
При взаимодействии с иодидом калия – типичным восстановителем – нитрит калия проявляет окислительные свойства:
– межмолекулярные:
– реакции самоокисления- самовосстановления (диспропорционирования):
– внутримолекулярные реакции окисления - восстановления:
Существуют два метода подбора коэффициентов в уравнениях окислительно-восстановительных реакций: метод электронного баланса и ионно-электронный метод (метод полуреакций). Метод электронного баланса. При подборе коэффициентов методом электронного баланса составляют схему реакции, расставляют степени окисления атомов окислителя и восстановителя, а также число отданных или принятых электронов. Число электронов, отданных восстановителем, должно равняться числу электронов, принятых окислителем. Например, реакция перманганата калия с сероводородом в сернокислой среде:
Вспомогательная электронная схема для нахождения основных коэффициентов в данном уравнении следующая: (восстановитель) (окислитель) Коэффициенты веществ, обусловливающих характер среды (кислота, щелочь или вода), подбираются в последнюю очередь. Уравнение в окончательном виде выглядит так: 2КМnО4 + 5H2S + 3H2SO4 = 2MnSO4 + 5S + K2SO4 + 8H2O. Признаком правильности подбора коэффициентов является равенство числа атомов каждого элемента в обеих частях уравнения. Ионно-электронный метод ( метод полуреакций ). Этот метод применим только для окислительно-восстановительных реакций, протекающих в растворах электролитов. В методе ионно-электронных полуреакций коэффициенты окислительно-восстановительной реакции определяют с учетом конкретной формы ионов, участвующих во взаимодействии. Преимущество метода состоит в том, что нет необходимости пользоваться формальным представлением о степени окисления; применяются реально существующие ионы. Кроме того, этот метод позволяет учесть влияние реакции среды на характер окислительно-восстановительного процесса, составить ионное уравнение реакции. При написании ионно-электронных полуреакций используют общие правила составления ионных уравнений, т.е. не электролиты, слабые электролиты, летучие соединения и труднорастворимые вещества записывают в молекулярном виде, а сильные электролиты – в ионном виде. При составлении ионно-электронных полуреакций необходимо использовать правила стяжения и два вывода, вытекающих из них: 1. Если продукт реакции содержит больше кислорода, чем исходное вещество, то расходуется либо вода - в нейтральных и кислых растворах, либо ионы ОН - - в щелочных растворах. Составим ионно-электронную полуреакциюв нейтральной среде:
Продукт реакции Составим ионно-электронную полуреакциюв щелочной среде: CrO2- + 4 OH- - 3 eˉ ® CrO42-+2H2O. В данной полуреакции недостающий кислород берется из гидроксид-ионов, т.к. среда щелочная). 2. Если продукт реакции содержит меньше кислорода, чем исходное вещество, то в кислой среде образуется вода, а в нейтральной и щелочной – ионы ОН-. Составим ионно-электронную полуреакциюв кислой среде:
Составим ионно-электронную полуреакциюв нейтральной среде:
Реакции окисления-восстановления могут протекать в кислой, нейтральной или щелочной среде, т.е. в уравнение реакции, кроме восстановителя и окислителя, вводится кислота (чаще Н2SO4), щелочь (чаще NaOH) или вода. Является ли данное вещество окислителем или восстановителем, нередко зависит от среды. В зависимости от среды может меняться и характер протекания процесса между одними и теми же веществами. Это очень четко можно проследить на примере взаимодействия перманганата калия с сульфитом натрия в различных средах. Наибольшую окислительную активность
В ряде случаев за счет среды можно даже изменить направление процесса.Так, реакция 3I2 + 3H2O → HIO3 + 5HI в щелочной среде протекает слева направо, а в кислой – справа налево. Таким образом, можно сделать вывод: реакции окисления-восстановления, их направление, а также характер образующихся продуктов зависят от той среды, в которой реакция протекает. Разберем методику составления ионно-электронных полуреакций для процессов окисления-восстановления, протекающих в различных средах. Пример 2. Определите и расставьте коэффициенты в уравнении окислительно-восстановительной реакции, протекающей в кислой среде, методом ионно-элект -ронного баланса:
+3 +6 +5 +3 KNO2 + K2Cr2O7 + H2SO4® KNO3 + Cr2(SO4)3 + K2 SO4 + H2O.
В схеме реакции определяем элементы, изменяющие степень окисления (с.о.)– это азот, имеющий с.о. +3 в ионе NO2-, а в ионе NO3- его с.о. повышается до +5, следовательно, идет процесс окисления азота; вторым элементом, меняющим степень окисления, является хром, который в ионе Cr2O72- имеет с.о. +6 и понижает с.о. до +3 в правой части уравнения, т.е. восстанавливается. Составляем ионно-электронные полуреакции сначала для процесса окисления: +3 +5 NO2- + 2 H2O – 2e ® NO3- + 2H+. Восстановителем является ион Окислитель – ион +6 +3
Поскольку количество отданных и принятых электронов должно быть равным, определяем дополнительные множители для процесса окисления и процесса восстановления по правилу нахождения наименьшего общего кратного:
На полученные множители умножаем каждую полуреакцию; затем суммируем полуреакции, и после приведения подобных членов получаем ионное уравнение окислительно-восстановительной реакции:
По ионному уравнению составляем молекулярное уравнение реакции: 3KNO2 + K2Cr2O7 +4 H2SO4® 3KNO3 + Cr2(SO4)3 + K2 SO4 + 4H2O. Рассмотренный многоступенчатый метод составления уравнения окислительно-восстановительной реакции приведен для понимания логики решения этой задачи. По мере появления опыта число промежуточных уравнений может быть уменьшено, а в пределе все ступени могут быть выполнены при написании лишь одного уравнения. Пример 3. Нахождение коэффициентов ионно-электронным методом в уравнении окислительно-восстановительной реакции, протекающей в нейтральной среде:
+ 4 + 7 + 6 + 4 Na2SO3 + KMnO4 + H2O ® Na2SO4 + MnO2 + KOH. среда Используя тот же подход для нахождения стехиометрических коэффициентов при взаимодействии веществ в нейтральной среде, запишем:
Избыточный кислород в нейтральной среде Умножаем полуреакции окисления и восстановления на соответствующие множители и суммируем:
В результате реакции образуется восемь гидроксид-ионов и шесть ионов водорода. Совместное присутствие их невозможно из-за протекания реакции:
Окончательно преобразованное ионное уравнение реакции следующее:
В молекулярной форме
Пример 4. Нахождение коэффициентов ионно-электронным методом в уравнении окислительно-восстановительной реакции, протекающей в щелочной среде: +2 +5 +6 -1 МnSO4 + KClO3 + KOH ® K2MnO4 + KCl + K2SO4 + H2O среда Мn2+ + 8OH- - 4eˉ ® MnO42- + 4 H2O | 3 о-е, в-ль ClO3- + 3 H2O + 6eˉ ® Cl- + 6OH- | 2 в-е, о-ль ________________________ 3 Мn2+ +2 ClO3- +6eˉ ® Cl- + 6OH-. В щелочной среде недостающий кислород (процесс окисления) присоединяется за счет ионов OH-, а избыточный кислород (процесс восстановления) связывается молекулами воды. В молекулярной форме полученное уравнение имеет следующий вид:
Пример 5. Нахождение коэффициентов в ОВР в случае, когда восстановитель или окислитель расходуется дополнительно на связывание получающихся продуктов. В приведенном ниже уравнении азотная кислота является окислителем и средой одновременно: 0 +5 +2 +5 +2 Cu + HNO3 ® Cu(NO3)2 + NO + H2O Cu – 2еˉ ® Cu2+ |3 о-е, в-ль NO3- + 4 Н+ + 3еˉ ® NO +4Н2О |2 в-е, о-ль
При составлении молекулярного уравнения возникает вопрос: какой коэффициент должен быть поставлен перед азотной кислотой (2 или 8)? В подобных случаях для правильного решения вопроса нужно руководствоваться следующим: если окислитель или восстановитель одновременно выполняет и функцию среды, то в молекулярном уравнении для данного вещества должен быть взят коэффициент, стоящий перед тем ионом, который участвует в реакции в большем количестве.
В этой реакции 2 молекулы
о-ль среда Пример 6. Нахождение коэффициентов в ОВР в случае, когда восстановителем и окислителем являются различные атомы одного и того же элемента, входящие в состав разных веществ. Примером может служить реакция между иодидом калия и иодатом калия, протекающая в кислой среде: -1 +5 0 KI + KIO3 + H2SO4 ® I2 + K2SO4 + H2O
Если числа электронов, теряемых восстановителем и принимаемых окислителем, являются четными, то при нахождении коэффициентов эти числа делят на наибольший общий делитель. Так, в данной реакции коэффициентами для восстановителя и окислителя будут не 10 и 2, а 5 и 1. Таким образом, уравнения принимают следующий вид:
Пероксиды (например, Пероксиды являются сильными окислителями. Окислительная способность пероксида водорода проявляется как в кислой, так и в нейтральной и щелочной среде. Восстановление
В нейтральной и щелочной среде реакция протекает с образованием
Пример 7. Нахождение коэффициентов в ОВР в случае, когда пероксид водорода проявляет окислительные свойства в кислой среде:
+2 -1 +3 -2 FeSO4 + H2O2 + H2SO4 ® Fe2 (SO4)3 + H2O в-ль о-ль
Fe2+ - еˉ ® Fe3+ |2 о-е, в-ль H2O2 + 2Н+ +2 еˉ ® 2 H2O |1 в-е, о-ль __________________
2FeSO4 + H2O2 + H2SO4 ® Fe2 (SO4)3 + H2O. Пример 8. Нахождение коэффициентов в ОВР в случае, когда пероксид водорода проявляет окислительные свойства в щелочной среде: +3 -1 +6 -2 KCrO2 + H2O2 + NaOH ® K2CrO4 + Na2 CrO4 + H2O
При взаимодействии с сильными окислителями (например, Окисление
а в щелочной среде:
Пример 9. Нахождение коэффициентов в ОВР в случае, когда пероксид водорода проявляет восстановительные свойства в кислой среде. -1 +7 0 +2
5 | 2 |
Пример 10. Нахождение коэффициентов в ОВР в случае, когда пероксид водорода проявляет восстановительные свойства в кислой среде:
-1 +3 0 0
Пример 11. Нахождение коэффициентов в ОВР в случае, когда реакция протекает с участием двух восстановителей. Рассмотрим окисление сульфида мышьяка концентрированной азотной кислотой: +3 -2 +5 +5 +6 +4
В рассматриваемом примере восстановителями являются атомы мышьяка и серы. 1 | 28|
Если в реакции участвует два восстановителя или два окислителя, то количество отданных или принятых ими электронов необходимо суммировать.
Пример 12. Нахождение коэффициентов в ОВР в случае, когда протекает реакция самоокисления-самовосстановления. В реакциях данного типа участвуют молекулы, атомы или ионы одного и того же вещества, способные проявлять и окислительные, и восстановительные свойства. Уравнения этих реакций составляются по тем же правилам, что и уравнения других реакций окисления-восстановления. +3 +3 +5 +2
1 | 2|
Окислительно-восстановительные потенциалы в реакциях окисления-
|

 ,
,  ,
,  и тд.;
и тд.;

 ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  и др), способные только понижать степень окисления. Самый сильный окислитель – электрический ток (окисление происходит на аноде). В лаборатории в качестве окислителя чаще всего применяют KMnO4, K2Cr2O7, HNO3, H2SO4 (конц.), Н2О2.
и др), способные только понижать степень окисления. Самый сильный окислитель – электрический ток (окисление происходит на аноде). В лаборатории в качестве окислителя чаще всего применяют KMnO4, K2Cr2O7, HNO3, H2SO4 (конц.), Н2О2. ,
,  ,
,  ,
,  ,
,  ,
,  и др.) и, следовательно, способные только повышать свою степень окисления; катионы, степень окисления которых может возрасти (
и др.) и, следовательно, способные только повышать свою степень окисления; катионы, степень окисления которых может возрасти ( ,
,  ,
,  и др.). В лаборатории в качестве восстановителей обычно применяются следующие кислоты и их соли: H2SO3, HI, Н3РО3, H2S, HNO2.
и др.). В лаборатории в качестве восстановителей обычно применяются следующие кислоты и их соли: H2SO3, HI, Н3РО3, H2S, HNO2. ,
, 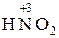 и их соли;
и их соли; 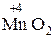 ,
,  ,
,  и т. д.). Так, нитрит калия в присутствии К2Сг2O7 – сильного окислителя, играет роль восстановителя:
и т. д.). Так, нитрит калия в присутствии К2Сг2O7 – сильного окислителя, играет роль восстановителя: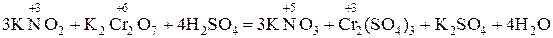 .
. . Различают следующие окислительно-восстановительные реакции:
. Различают следующие окислительно-восстановительные реакции: ;
; ;
; ;
; ;
; ;
; .
.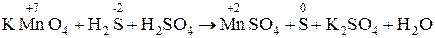 .
.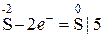 (окисление)
(окисление)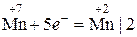 (восстановление)
(восстановление) .
. содержит больше кислорода, чем исходное вещество
содержит больше кислорода, чем исходное вещество  . Следовательно, в нейтральной и кислой среде недостающий кислород берется из воды.
. Следовательно, в нейтральной и кислой среде недостающий кислород берется из воды. 

 (точнее, ион
(точнее, ион  ) проявляет в кислой среде, восстанавливаясь до
) проявляет в кислой среде, восстанавливаясь до 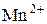 , меньшую – в нейтральной, восстанавливаясь до
, меньшую – в нейтральной, восстанавливаясь до  , самым слабым окислителем
, самым слабым окислителем  :
: (рН< 7);
(рН< 7); (рН=7);
(рН=7); (рН> 7).
(рН> 7). , который окисляется до иона
, который окисляется до иона  . Получающийся при реакции ион
. Получающийся при реакции ион  содержит больше кислорода, чем ион
содержит больше кислорода, чем ион  в кислой среде восстанавливается до двух элементарных ионов Сr3+, не содержащих кислорода, принимая 6 электронов. Освобождающийся кислород взаимодействует с ионами водорода, образуя воду:
в кислой среде восстанавливается до двух элементарных ионов Сr3+, не содержащих кислорода, принимая 6 электронов. Освобождающийся кислород взаимодействует с ионами водорода, образуя воду:

 о-е; в-ль
о-е; в-ль в-е; о-ль.
в-е; о-ль.


 .
.
 о-е; в-ль
о-е; в-ль в-е; о-ль.
в-е; о-ль.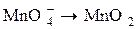 стягивается с молекулами воды с образованием гидроксид-ионов (правила стяжения).
стягивается с молекулами воды с образованием гидроксид-ионов (правила стяжения). .
.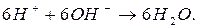
 .
.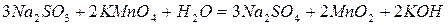 .
.


 реагируют как окислитель, а 6 молекул расходуются в качестве среды – на солеобразование. В реакциях такого типа одно и то же вещество можно вписывать в уравнение дважды.
реагируют как окислитель, а 6 молекул расходуются в качестве среды – на солеобразование. В реакциях такого типа одно и то же вещество можно вписывать в уравнение дважды.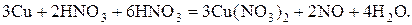




 5 о-е; в-ль
5 о-е; в-ль 1 в-е; о-ль
1 в-е; о-ль



 ) содержат кислород в степени окисления –1, который в присутствии восстановителей может понижать степень окисления до –2, а при взаимодействии с окислителями способен повышать степень окисления до 0 и превращаться в свободный кислород.
) содержат кислород в степени окисления –1, который в присутствии восстановителей может понижать степень окисления до –2, а при взаимодействии с окислителями способен повышать степень окисления до 0 и превращаться в свободный кислород. в кислой среде протекает с образованием
в кислой среде протекает с образованием  по уравнению:
по уравнению:
 :
: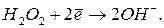

 CrO2- + 4OH- – 3e- ® CrO4 2- + 2 H2O о-е; в-ль
CrO2- + 4OH- – 3e- ® CrO4 2- + 2 H2O о-е; в-ль в-е; о-ль
в-е; о-ль

 и др.) пероксид водорода проявляет восстановительные свойства в кислой и щелочной средах.
и др.) пероксид водорода проявляет восстановительные свойства в кислой и щелочной средах.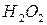 в кислой среде протекает по уравнению:
в кислой среде протекает по уравнению:

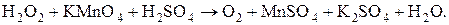


 о-е; в-ль
о-е; в-ль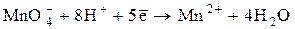 в-е; о-ль __________________________________
в-е; о-ль __________________________________



 о-е; в-ль
о-е; в-ль
 в-е; о-ль
в-е; о-ль



 + о-е; в-ль
+ о-е; в-ль в-е; о-ль
в-е; о-ль 


 о-е; в-ль
о-е; в-ль в-е; о-ль
в-е; о-ль




