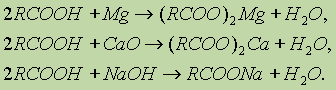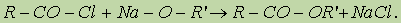Физические свойства.
Низшие члены этого ряда(С1— С9) представляют собой жидкости, обладающие характерным острым запахом. Средние представители ряда—вязкие, “маслообразные” жидкости; начиная с С10 — твердые вещества. Кислоты, содержащие 1—3 углеродных атома, неограниченно смешиваются с водой. С дальнейшим ростом углеводородного радикала растворимость монокарбоновых кислот уменьшается, твердые высшие жирные кислоты в воде не растворяются(поэтому не являются электролитами и не изменяют окраску индикаторов). Ненасыщенные кислоты, как правило, жидкости. Все дикарбоновые и ароматические кислоты при комнатной температуре — кристаллические вещества.
Строение. Карбоксильная группа СООН состоит из карбонильной группы С==O и гидроксильной группы ОН, которые оказывают взаимное влияние друг на друга. В группе СО атом углерода несет частичный положительный заряд и притягивает к себе неподеленную электронную пару атома кислорода в группе ОН. При этом электронная плотность на атоме кислорода уменьшается и связь O-Н ослабляется (увеличиваются кислотные свойства):
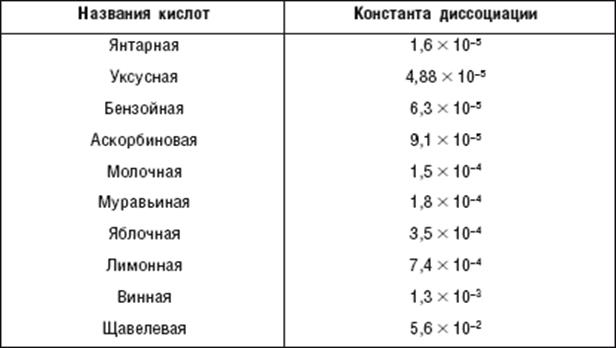
В свою очередь, группа ОН “гасит” положительный заряд на группе СО, которая из-за этого теряет способность к реакциям присоединения, характерным для карбонильных соединений. Химические свойства. 1. Диссоциация кислот. В водном растворе карбоновые кислоты диссоциируют:
Однако это равновесие диссоциации сильно сдвинуто влево, поэтому карбоновые кислоты, как правило, слабые кислоты. Вследствие взаимного влияния атомов в молекулах дикарбоновых кислот они являются более сильными, чем одноосновные. 2. Образование солей. Карбоновые кислоты обладают всеми свойствами обычных кислот: реагируют с активными металлами, основными оксидами, основаниями:
Карбоновые кислоты — слабые, поэтому сильные минеральные кислоты вытесняют их из соответствующих солей. 3. Образование функциональных производных. При замещении группы ОН в карбоновых кислотах различными группами (X) образуются функциональные производные кислот, имеющие общую формулу R—СО—X; здесь R означает алкильную либо арильную группу. Хлорангидриды получают действием хлорида фосфора(V) на кислоты:
Сложные эфиры образуются при нагревании кислоты со спиртом в присутствии серной кислоты (обратимая реакция этерификации):
Механизм реакции этерификации был установлен методом “меченых атомов”. Сложные эфиры можно также получить при взаимодействии хлорангидридов кислот и алкоголятов щелочных металлов:
Реакции хлорангидридов карбоновых кислот с аммиаком приводят к образованию амидов:
|