Строение и свойства
Номенклатура, изомерия 1) заместительная (систематическая) номенклатура ИЮПАК 2) рациональная номенклатура. Тривиальное название широко распространено только для родоначальника ряда: НС º CН — ацетилен.
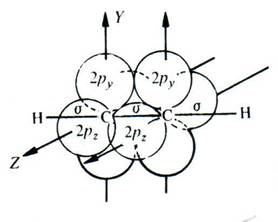
Для алкинов характерны те же виды структурной изомерии, что и для алкенов. В отличие от алкенов здесь невозможна геометрическая изомерия, так как все три s-связи в ацетиленовом фрагменте (атомы углерода sp- гибридизованы) лежат на одной прямой. Среди алкинов выделяют группу терминальных алкинов — это углеводороды с концевым расположением тройной связи, например
В этих углеводородах у одного из атомов тройной связи имеется водород, что определённым образом отражается на свойствах этой группы соединений.
строение и свойства
Реакции электрофильного присоединения
Алкины менее активны в реакциях электрофильного присоединения. Причины: 1) p-электронная плотность тройной связи сильнее притягивается sp -гибридизованными атомами углерода из-за меньшего расстояния между ними, и потому атакующему электрофилу труднее оторвать пару электронов от такой связи; 2) катион, образующийся в результате присоединения электрофильной частицы к тройной связи, менее устойчив, так как не может быть стабилизирован ни сверхсопряжением, ни каким-либо другим видом сопряжения:
3) превращение образовавшегося катиона в нейтральную молекулу продукта должно произойти при его взаимодействии с анионом из реакционной среды, однако этому препятствует наличие p-электронной плотности в катионе.
R-C º C-R ¢
и вторая стадия, как правило, осуществляется быстрее первой, так как она представляет собой присоединение по двойной связи.
Присоединение галогеноводородов (1 или 2 молей):
R-C º C-R ¢
Гидратация тройных связей (реакция М.Г. Кучерова):
R-C º CН + H2О
Механизм реакции:
Возможно проведение селективной гидратации тройной связи в присутствии двойной: CН2=CН-C º CН + H2О
Кислотные свойства: металлические производные алкинов
Для ацетиленовых углеводородов рКа»22 для этиленовых рКа»40. Кислотность алкинов выше и по сравнению с аммиаком, однако ниже, чем у воды и спиртов. R-С º C-Н + Na ® R-С º C-Na + R-С º C-Н + KNH2 ® R-С º C-K + NH3 R-С º C-Н + C2Н5MgBr ® R-С º C-MgBr + C2Н6 R-С º C-MgBr — реактивы Иоцича.
Н-С º C-Н + 2[ Ag (NH3) 2 ] OH ® Ag-С º C-Ag ¯ + 4 NH3 + 2 H2O реактив Толленса R-С º C - Na+ + C2Н5OH ® R-С º C-H + C2Н5ONa Соли алкинов являются эффективными нуклеофилами. Нуклеофил (или нуклеофильная частица) — это анион или нейтральная молекула, имеющая неподелённую пару электронов на одном из атомов, за счёт которой происходит образование новой связи этого атома с атомом углерода субстрата.
Примером таких реакций является взаимодействие нуклеофилов с галогеналканами, которое широко используется для получения алкинов из ацетилена:
R-С º C - Na+ + C2Н5Br ® R-С º C-C2Н5 + NaBr
Реакция Реппе: НC º CН + 2 СН2O
Образовавшийся бут-2-ин-1,4-диол по Реппе далее превращается в бутадиен:
НОCН2-C º С-CН2OН
Нуклеофильное присоединение В отличие от этиленовых углеводородов к алкинам могут присоединяться реагенты по нуклеофильному механизму.
Схема реакции:
Механизм:
(Н +)
Частным случаем такой реакции является ещё одна реакция Репе (винилирование спртов):
НC º CН + ROH
Кроме спиртов в эту реакцию с ацетиленом вступают фенолы, тиоспирты, амины, карбоновые кислоты и некоторые другие соединения. Эти реакции протекают при нагревании до 150-180°С под давлением 7-35 атм.
Алкины более активны по отношению к нуклеофилам в сравнении с алкенами. Причины: 1) бóльшая локализацией p-электронной плотности тройной связи, что увеличивает доступность атомов углерода для нуклеофильной атаки, 2) присоединение нуклеофила сопровождается возникновением р -p-сопряжённого фрагмента в карбанионе.
Циклотримеризация (ароматизация)
Реакции радикального замещения Ацетиленовые углеводороды ещё легче, чем этиленовые, должны вступать в реакции радикального замещения вследствие более полной мезомерной стабилизации промежуточного радикала: R-CH2-C º CH + Cl ×;® R- Ċ;H-C º CH + HCl Реакции изомеризации R-CH2-C º CH ®[ R-CH=C=CH2 ] ® R-C º C-CH3
Реакции окисления Окисление концентрированным раствором KMnO4:
Действие озона на непредельные углеводороды приводит к образованию озонидов, которые легко гидролизуются до карбонильных соединений:
дальнейшее окисление может привести к образованию карбоновых кислот RCOOH и R'COOH.
|


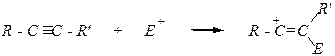 ;
; R-CBr=CBr-R ¢
R-CBr=CBr-R ¢ 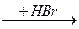 R-CH=CBr-R ¢
R-CH=CBr-R ¢ 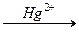 R-CО-CH3
R-CО-CH3 

 H2
H2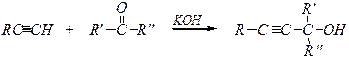 — это реакция Фаворского, протекающая в присутствии твёрдой щёлочи.
— это реакция Фаворского, протекающая в присутствии твёрдой щёлочи. НОCН2-C º С-CН2OН
НОCН2-C º С-CН2OН НОCН2-CН2CН2-CН2OН ®
НОCН2-CН2CН2-CН2OН ®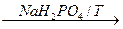 CН2=CН-CН=CН2
CН2=CН-CН=CН2 

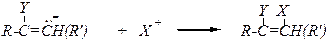
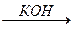 CН2=CН-О-R
CН2=CН-О-R

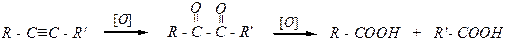 .
.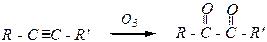 ,
,


