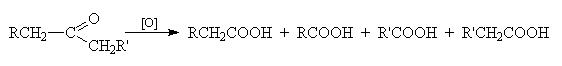Окисление альдегидов и кетонов
Альдегиды очень легко окисляются в соответствующие карбоновые кислоты под действием даже таких мягких окислителей, как оксид серебра и гидроксид меди (II). Окисление происходит по связи С–Н в альдегидной группе –СН=О, которая превращается при этом в карбоксильную группу –С(OH)=O. Альдегиды медленно окисляются кислородом воздуха в карбоновые кислоты:
Качественная реакция на альдегиды – реакция "серебряного зеркала"; – окисление аммиачным раствором оксида серебра (реактив Толленса): R–CH=O + 2[Ag(NH3)2]OH Реакцию проводят при температуре, близкой к температуре кипения воды (80–100 °С). В результате на стенках стеклянного сосуда (пробирки, колбы) образуется осадок металлического серебра Окисление гидроксидом меди (II): а)в виде свежеприготовленного осадка Cu(OH)2 при нагревании, б)в форме комплекса с аммиаком [Cu(NH3)4](OH)2 в) в составе комплекса с солью винной кислоты (реактив Фелинга). При этом образуется красно-кирпичный осадок оксида меди (I) или металлическая медь (реакция "медного зеркала", более характерная для формальдегида): R-CH=О + 2Cu(OH)2 Окисление альдегидов сильными окислителями в растворе приводит к образованию карбоновых кислот.
Реакция проходит по радикальному механизму через образование гидроперекисей. Для сохранения альдегидов от окисления атмосферным воздухом к ним прибавляют небольшие количества антиоксидантов, блокирующих свободные радикалы. В качестве антиоксидантов используют ароматические амины и фенолы.
Кетоны к действию окислителей весьма устойчивы и окисляюся лишь сильными окислителями при нагревании. В процессе окисления происходит разрыв связей C-C по обе стороны карбонильной группы и в общем случае получается смесь четырех карбоновых кислот:
Циклические кетоны окисляются в лактоны (циклические эфиры):
|

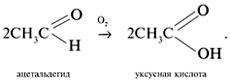
 RCOOH + 2Ag↓ + 4NH3 + H2O
RCOOH + 2Ag↓ + 4NH3 + H2O