(№ 271 – 300)
271−280. Какие окислительно-восстановительные процессы происходят при контакте железного изделия (Fe) с представленными в табл. металлами (Me)? Укажите, какой металл при этом окисляется? Приведите уравнения электродных процессов. Составьте схемы работы гальванических элементов, образующихся при коррозии металлов в данных условиях.
| №
задачи
| Металлы, контактирующие с железным изделием (Fe/Me)
| Коррозионная среда
|
|
| Zn, Cr
| раствор H2SO4
|
|
| Zn, Cu
| влажная атмосфера (Н2О+О2)
|
|
| Ni, Cr
| влажная промышленная атмосфера (H2O, SO2, HCl, CO2)
|
|
| Sn, Al
| пресная вода
|
|
| Ag, Cr
| pН <7 (отсутствие кислорода)
|
|
| Co, Mg
| влажная атмосфера (Н2О+О2)
|
|
| Zn, Sn
| морская вода (Н2О+Cl-)
|
|
| Cd, Ni
| раствор электролита (рН > 7)
|
|
| Mg, Sn
| влажная промышленная атмосфера (H2O, SO2, HCl, CO2)
|
|
| Pb, Cd
| влажная атмосфера (Н2О+О2)
|
281−285. Железная пластина (Fe) имеет покрытие из другого металла. Какой из металлов (железо или металл покрытия) будет разрушаться в случае нарушения поверхностного слоя покрытия? Составьте схемы процессов, происходящих на электродах образующихся гальванических элементов в указанных средах.
| № задачи
| Металл покрытия
| Коррозионная среда
|
|
| Cu, Mg
| пресная вода
|
|
| Zn, Sn
| морская вода (Cl−)
|
|
| Sn, Al
| кислая среда
|
|
| Ag, Zn
| влажная атмосфера (Н2О+О2)
|
|
|
Ni, Ag
| влажная промышленная атмосфера (H2O, SO2, HCl, CO2)
|
286–290. Металл (Ме1) находится в контакте с другим металлом (Ме2). Укажите, какой из металлов будет подвергаться коррозии? Приведите уравнения электродных процессов, схемы образующихся микрогальванических элементов и рассчитайте ЭДС при стандартных условиях.
| № задачи
| Ме1/Ме2
| Коррозионная среда
|
|
| Al/Cu
| влажная атмосфера (Н2О+О2)
|
|
| Al/Cu
| кислый водный раствор (предполагается отсутствие О2)
|
|
| Sn/Fe
| влажная промышленная атмосфера
|
|
| Sn/Fe
| влажная атмосфера (Н2О+О2)
|
|
| Cu/Zn
| морская вода
|
291–294. Укажите, какой металл можно использовать в качестве протектора для защиты изделия от коррозии в водных растворах в контакте с воздухом? Приведите уравнения электродных процессов и схемы образующихся микрогальванических элементов.
| № задачи
| Изделие
| № задачи
| Изделие
|
|
| Fe
|
| Zn
|
|
| Sn
|
| Ni
|
295–298. Рассмотрите коррозию изделия в электролите, содержащем соляную кислоту. Приведите уравнения электродных процессов и схемы образующихся гальванических элементов.
| № задачи
| Изделие
| № задачи
| Изделие
|
|
| оловянистая бронза
(Cu/Sn 8…10%)
|
|
cплав Sn/Ag
|
|
| сплав Cu/Ag
|
| луженое железо
|
299–300. Рассмотрите коррозию изделия во влажной атмосфере. Приведите уравнения электродных процессов, состав продуктов коррозии и схемы образующихся коррозионных гальванических элементов.
| № задачи
| Изделие
| № задачи
| Изделие
|
|
| латунь
(сплав Cu/Zn)
|
| алюминиевая бронза (Cu/Al)
|
ПРИЛОЖЕНИЕ
Таблица 1
Основные физико-химические константы
| Величина
| Обозначение
| Численное значение
|
| Заряд электрона и протона (элементарный электрический заряд)
|
e
|
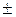 1,6022 · 10 −19 Кл 1,6022 · 10 −19 Кл
|
| Масса электрона
|
me
|
9,1094 ·10 −31 кг
|
| Масса протона и нейтрона
| mp, mn
|
1,6726 · 10 −27 кг
|
| Постоянная (число) Авогадро
| NA
| 6,0221 · 10 23 моль−1
|
|
Газовая постоянная
| R
| 8,31 Дж · моль−1· K–1;
8,31 Вт · с · моль−1· K–1;
2,31 кВт · ч · моль−1· K–1;
0,0821 л · атм · моль−1· K –1
|
| Постоянная Больцмана k = R / NA
|
k
|
1,3807·10 −23 Дж · К−1
|
| Постоянная (число) Фарадея F = N А · е
|
F
|
96485,3 Кл · моль−1
|
| Постоянная Планка
|
h
|
6,6261 ·10 –34 Дж · с
|
| Электрон-вольт
| эВ
|
1,6022 ·10 −19 Дж
|
| Нормальные условия
|
н.у.
|
ро = 101,3 кПа; То = 273,15 К
|
| Нормальный молярный
объем газа
|
Vо
|
22,4 л/моль
|
| Стандартные термодинамические условия
|
|
р = 101,3 кПа; Т = 298,15 К
|
| Скорость света в вакууме
| С
| 2,9979 · 10 8 м · с−1
|
Таблица 2

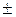 1,6022 · 10 −19 Кл
1,6022 · 10 −19 Кл



