Этап 1. Определение теплоёмкости калориметрической системы. По формуле (6) рассчитывают постоянную калориметра.
А) Расчетный метод По формуле (6) рассчитывают постоянную калориметра.
Б) Экспериментальный метод
1. Обработку результатов начинают с построения графика зависимости
2. После этого находят постоянную калориметра K. На основании приведенных в таблице 3 справочных данных строят график зависимости интегральной теплоты растворения взятой для эксперимента соли от моляльной концентрации раствора. Рассчитывают моляльную концентрацию получившегося раствора, принимая плотность воды раной 1 г/см3. По графику определяют величину Таблица 3 Интегральные теплоты растворения хлорида калия и хлорида аммония в воде
Постоянную калориметра рассчитывают по формуле (8). Эту величину используют в дальнейших расчетах. 2. После этого находят постоянную калориметра K. На основании приведенных в таблице 4 справочных данных строят график зависимости интегральной теплоты растворения взятой для эксперимента соли от моляльной концентрации раствора. Рассчитывают моляльную концентрацию получившегося раствора, принимая плотность воды раной 1 г/см3. По графику определяют величину Таблица 4 Интегральные теплоты растворения хлорида калия и хлорида аммония в воде
Постоянную калориметра рассчитывают по формуле (8). Эту величину используют в дальнейших расчетах. 3. На основании экспериментальных данных строят графики зависимости температуры в калориметре от времени (рис. 4, а – для безводной соли, б – для кристаллогидрата) в масштабе 1 мин = 1 см, 1° = 10 см. Экстраполяцией температурных зависимостей на 11-ю минуту определяют истинное повышение температуры в процессе растворения для безводной соли и для кристаллогидрата.
Рис. 4. Зависимость температуры в калориметре от времени (а – опыт с безводной солью, б – опыт с кристаллогидратом) 4. Интегральную теплоту растворения безводной соли в Дж/моль рассчитывают по формуле:
где
c = 4,10 Дж/г·К – теплоемкость раствора;
5. Интегральную теплоту растворения кристаллогидрата в Дж/моль определяют по формуле:
где
6. Теплоту образования кристаллогидрата рассчитывают по уравнению (4). 7. Делают выводы по работе. Отвечают на вопросы. 7.1. Какой тип калориметра использован в работе? 7.2. Почему измеренное значение Скс не равно теплоемкости 400 г воды, залитой в калориметр ( 7.3. Как отличаются знаки теплот растворения CuSO4 и CuSO4∙5Н2О в воде? Почему? 7.4. Табличное значение
ЛИТЕРАТУРА
1. Практикум по физической химии / Под ред. В.В. Буданова и Н.К. Воробьева. – М.: Химия, 1986. – С. 117-118. 2. Практикум по физической и коллоидной химии / Под ред. К.И. Евстратовой. – М.: Высш. шк., 1990. – С. 12-21.
|

 , полученной на этапе 1, и нахождения
, полученной на этапе 1, и нахождения  (таблица 1).
(таблица 1).
 при той моляльной концентрации, которая имела место в опыте.
при той моляльной концентрации, которая имела место в опыте.


 (6)
(6)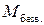 – молярная масса безводной соли;
– молярная масса безводной соли; – масса воды;
– масса воды; – истинная навеска безводной соли;
– истинная навеска безводной соли; – скачок температуры при растворении безводной соли, определенный графически;
– скачок температуры при растворении безводной соли, определенный графически; – постоянная калориметра.
– постоянная калориметра. (7)
(7) – молярная масса кристаллогидрата;
– молярная масса кристаллогидрата; – навеска кристаллогидрата,
– навеска кристаллогидрата, – скачок температуры при растворении кристаллогидрата, определенный графически,
– скачок температуры при растворении кристаллогидрата, определенный графически,  ).
).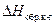 = –78,87 кДж/моль. Каковы абсолютная и относительная ошибки Вашего эксперимента?
= –78,87 кДж/моль. Каковы абсолютная и относительная ошибки Вашего эксперимента?



