Силилирование
В 60-х гг. ХХ в. после внедрения в практику аналитической химии силилирующих реактивов для газовой хроматографии они стали рассматриваться как основные реактивы для модификации полифункциональных веществ. Используя эти реактивы, модифицирование можно осуществить в один-два этапа. К настоящему моменту разработаны и широко применяются на практике многочисленные силилирующие реактивы, с помощью которых можно получить несколько видов производных — от триметилсилильных до трет -бутилдиметилсилильных и др. В зависимости от природы вещества и реагента силилирование идет с разной скоростью и выходом. Так, возможен перевод анализируемого вещества в его полный эфир непосредственно в испарителе хроматографа, в других случаях необходима длительная обработка силилирующим агентом с последующим удалением избытка реактива и растворителя. Для определения пестицидов в объектах окружающей среды и в биообъектах иногда используют силильные реактивы, в метильных группах молекул которых один или два атома водорода заменены на бром. Получаемые с помощью такого вида реактивов производные исследуют с применением ДЭЗ или ПФД, что позволяет достичь высокой чувствительности и селективности определения анализируемых веществ. Ацилирование Этот способ дериватизации широко используется для определения веществ, имеющих свободную гидроксигруппу (фенольную или спиртовую), а также ароматическую или алифатическую аминогруппу. Определение наркотиков (амфетамины, опиаты), стероидов и многих других веществ осуществляют с применением ангидридов или перфтороангидридов уксусной, пропионовой или масляной кислот. Производные фторированных кислот имеют большое сродство к электронам и поэтому определяются ДЭЗ с высокой чувствительностью. Преимуществами рассматриваемых реактивов являются их дешевизна, простота выполнения реакции, значительное улучшение хроматографических свойств аналитов. Однако обработка этими реактивами веществ, в химической структуре которых имеется несколько реакционноспособных заместителей, может привести к частичной дегидратации и (или) циклизации нескольких молекул аналита, что скажется на результатах количественного определения. Иногда ангидриды кислот заменяют хлороангидридами или другими веществами, способными отщеплять ацильный фрагмент. Присутствие в анализируемой пробе веществ, способных вызывать переэтерификацию других компонентов смеси, приводит к неправильной интерпретации полученных результатов, например, ацетилсалициловая кислота, которая легко, особенно при нагревании, ацетилирует гидроксильные и аминогруппы. Так, в незаконном обороте наркотиков часто встречаются смеси героина и ацетилсалициловай кислоты, пробы которых при газохроматографическом и хромато-масс-спектральном исследованиях дают отрицательный результат на содержание морфина, кодеина и монозамещенных морфина. В то же время при исследовании этих же образцов методами ТСХ и ВЭЖХ метаболиты указанных наркотиков однозначно определяют. Поэтому эксперты, не имеющие достаточного опыта, часто допускают грубейшую ошибку при интерпретации результатов исследования смеси ацетилсалициловой кислоты с наркотиками, особенно часто при определении амфетамина или его аналогов, делая не соответствующее действительности заключение об отсутствии в пробе контролируемых веществ. Ацетилсалициловая кислота легко взаимодействует со спиртами, при этом получаются не ацетильные производные, а салицилаты аналитов. Эта реакция легла в основу методики разделения метилового и этилового спиртов. При добавлении в смесь этих спиртов раствора ацетилсалициловой кислоты в разогретом инжекторе образуются метил- и этилсалицилаты, которые надежно разделяются на капиллярных колонках в условиях, подобранных для анализа наркотиков. Этот подход часто используется в лабораториях, которые не занимаются анализом низкомолекулярных веществ, и поэтому перенастройка приборов на их исследование не оправдана экономически, требует отвлечения от основной работы специалистов и оборудования. В 90-х гг. ХХ в. в практику газохроматографического исследования вошли новые дериватизирующие реактивы на основе метилхлороформиата (MCF) или этилхлороформиата (ECF), которые быстро и одновременно дериватизируют как амино- и гидрокси-, так и карбоксильные группы аналита. Этот новый класс мощных дериватизирующих реактивов имеет ряд преимуществ: проведение реакции в водной среде, совмещение нескольких стадий пробоподготовки в одну, что значительно снижает время проведения исследований. Кроме рассмотренных выше, известно большое число способов химической модификации аналитов, которые используются в ХТА при газохроматографическом исследовании. Например, при определении веществ из группы бензодиазепинов широко применяется кислотный гидролиз, в результате которого образуются обладающие хорошими хроматографическими свойствами бензофеноны; при исследовании в биологических объектах оксимаслянной кислоты часто прибегают к переводу ее в γ-бутиролактон, который затем количественно определяют. Дериватизация позволяет применять газовую хроматографию и для определения в биологических объектах ряда металлов в виде их дитизонатов, однако чаще для определения металлов используются другие методы. В современном приборостроении очевидна тенденция к полной автоматизации всех этапов исследования, так что следует ожидать появления новых реактивов и оборудования для дериватизации. В отчете в графе RI приведены значения индексов удерживания, полученные в условиях программирования температуры колонки. Перед проведением исследований методом газовой хроматографии рекомендуется проводить исследование тестовой смеси веществ в следующих условиях:
Компонентный состав тестовой смеси и присвоенные им индексы удерживания представлены в таблице ниже.
Вычисление индексов удерживания в предлагаемых условиях осуществляется по следующей формуле:
Метод газовой хроматографии постоянно развивается, появляются все новые направления его применения, растут селективность и чувствительность определения, появляются новые материалы, колонки и реактивы. В этом разделе рассматриваются только некоторые из перспективных направлений. Быстрая капиллярная хроматография высокого разрешения. С появлением капиллярной хроматографии создалась ситуация, когда эффективность колонки в большинстве случаев настолько превосходит необходимый для решения конкретной аналитической задачи предел, что это приводит к неоправданному увеличению времени проведения исследований. Сократить его без потери эффективности проще всего двумя путями: уменьшением длины колонки и увеличением линейной скорости газа-носителя. Ускорить анализ позволяют разработки последнего времени — поликапиллярные или многоканальные колонки, а также флеш-хроматография, при помощи которой на стандартных колонках удается осуществлять разделение веществ в 6–10 раз быстрее. Для этого применяется сверхбыстрая скорость нагрева колонки до 1200 ºС за 1 мин. Еще одним способом уменьшения времени анализа является использование сверхтонких колонок. Разрешающая способность колонки длиной 10 м и внутренним диаметром 0,1 мм равна разрешающей способности колонки длиной 25 м и внутренним диаметром 0,25 мм. Оптимальные условия разделения на короткой колонке позволяют проводить исследование сложных смесей в несколько раз быстрее. Такие колонки имеют преимущества в чувствительности при работе с потоковыми детекторами. Для достижения всех возможностей, предоставляемых ими, требуется современное оборудование с повышенной частотой сбора данных, эффективной печью, обеспечивающей скорость нагрева колонки до 100 ºС за 1 мин, стабильным (расход газа должен быть воспроизводим) электронным расходомером газов, а также современным устройством для ввода образцов, позволяющим дозировать образцы при делениях потока 1/500 или 1/1000. Такими характеристиками обладают современные хроматографы ведущих отечественных и зарубежных приборостроительных фирм. Системы фиксированного времени удерживания. Разработка таких систем стала возможна только после введения в практику капиллярной хроматографии оборудования с электронным пневматическим управлением расхода газа-носителя, улучшенным контролем над температурой колонки, а также наличие колоноксо стабильными свойствами, воспроизводимыми от партии к партии. Основываясь на этих достижениях, в настоящее время активно создаются системы, в которых удается так устанавливать и поддерживать рабочие характеристики оборудования, что ошибкой измерения времени удерживания как на каждом конкретном приборе, так и на разных, можно пренебречь. Другими словами, для идентификации веществ с помощью таких систем можно использовать абсолютное время удерживания вместо относительного. При этом и абсолютное, и относительно время будет одинаково на всех приборах с такими системами, как бы далеко они друг от друга ни располагались. В основе рассматриваемых систем лежит определение и нивелирование индивидуальных флуктуаций свойств конкретной хроматографической системы, воздействующих на время удерживания. Каждая фирма-производитель современного хроматографического оборудования, используя свои подходы, предоставляет хроматографисту определенные возможности. Например, фирма «Аджилент Тек.» (США) предлагает специальную программу для подключения уже разработанной конкретной методики определения к системе фиксированного времени удерживания (Retention Time Locking — RTL). Для этого в хроматограф вводится смесь исследуемых веществ и проводится ее анализ в идентичных условиях, за исключением давления на входе в колонку, которое устанавливается равным уже выбранному оптимальному давлению, а также отличающимся от него на 10 и 20% в ту или иную стороны. Таким образом, после пяти определений устанавливается влияние давления на время выхода одного из пиков смеси, чаще всего в ХТА используют для этого внутренний стандарт. Более общий и простой в исполнении способ предлагает фирма «Термо Электрон Корп.» (США). При установке колонки проводится тестирование ее параметров по разработанной фирмой программе, которая жестко вписана в память хроматографа. В результате в базу данных хроматографа заносятся все необходимые сведения о колонке и ее свойствах. Использование системы фиксированного времени удерживания в том или ином виде чрезвычайно упрощает работу аналитика. Откалиброванное оборудование способно выявлять на ранних стадиях необратимые загрязнения колонки и потерю ее работоспособности. В большей степени этот метод важен при использовании комбинированных методов капиллярной хроматографии со спектральными методами, например ГХ-МС, ГХ-ИК-Фурье-спектрометрии и (или) ГХ-УФ-спектрометрии многоколоночных приборов.
|

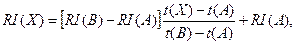 где
где индексы удерживания веществ А, В и Х, соответственно.
индексы удерживания веществ А, В и Х, соответственно. времена удерживания веществ А, В и Х, соответственно.
времена удерживания веществ А, В и Х, соответственно.


