Основные правила построения ионно-ковалентных структур
Структуру кристаллов со свойствами составляющих их атомов, впервые связал В. М. Гольдшмидт, который особое значение придавал размеру ионных радиусов. Л. К. Полинг сформулировал несколько правил построения структур ионных кристаллов.
Первое из этих правил является уточнением правила Гольдшмидта о связи координации ионов с их ионными радиусами и гласит, что каждый катион окружен анионами, находящимися в вершинах координационного полиэдра (многогранника) - рис. 6.
Рис. 6. Координационные многогранники: A –гантель (КЧ - 2); б – треугольник (КЧ -3); в – тетраэдр (КЧ - 4); г – октаэдр (КЧ-6); д – куб (КЧ-8); е – кубооктаэдр (КЧ -12)
Расстояние между центрами катиона и соседнего аниона определяется суммой ионных радиусов, а координационное число (КЧ) — их отношением (гк : rа). Второе правило — правило электростатической валентности — гласит, что в устойчивой ионной структуре сумма сил электростатических связей, соединяющих анион с окружающими его катионами, равна заряду аниона; при этом силой связи 5 называется отношение заряда катиона к числу окружающих его анионов. Сила связи катиона различна при изменении его координационного числа.
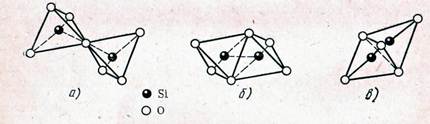
Третье правило говорит о том, что наличие в структуре общих ребер и особенно граней двух соседних полиэдров снижает устойчивость структуры. Это правило особенно существенно для многозарядных катионов с большими зарядами и низкими координационными числами, таких как Si+4.
Рис. 7. Различные способы соединения кремнекислородных тетраэдров: а — вершинами (устойчивая система); б — ребрами; в — гранями (неустойчивые системы)
Четвертое правило гласит, что если в структуре существует несколько видов катионов, то катионы с малыми координационными числами, но с более высоким зарядом стремятся к такой упаковке, чтобы их координационные полиэдры имели бы минимальное количество общих вершин. Пятое правило является правилом экономичности: химически идентичные ионы обычно имеют одинаковые координационные полиэдры и координационные числа в структуре. Два последних правила не имеют такой универсальности, как предыдущие. Согласно принципу минимума потенциальной энергии каждый атом стремится взаимодействовать с максимально большим числом других атомов. Это приводит к образованию плотнейших упаковок. Анализируя структуры, сложенные из различных атомов, Н. В. Белов показал, что к ним может быть приложен принцип плотнейшей упаковки. Пользуясь системами ионных радиусов, можно рассматривать геометрические возможности «заселения» пустот в упаковке анионов катионами. Эти возможности определяются пределами соотношений ионных радиусов, соответствующих тетраэдрической или октаэдрической координации. Однако в ионных структурах размеры катионов очень часто оказываются больше, чем нужно, из чисто геометрических соотношений, и они как бы раздвигают анионы.
Вопросы: 1. Какие методы изучения структуры кристаллических веществ Вы знаете? 2. Назовите правила построения ионно-ковалентных структур.
|