Строение электронных оболочек
Заполнение электронами энергетических уровней и подуровней происходит в соответствии с принципом минимальной энергии, правилами Гунда и Клечковского:
Пример 2. Сколько протонов и нейтронов содержат ядра изотопа Решение. 1. Количество протонов и нейтронов рассчитаем по формулам (2.1) и (2.2): Здесь заряд ядра атома кальция Z = 20, атомная масса изотопа кальция А = 41. Получим Р = 20, n = 41-20 = 21. 2. Используя алгоритм распределения электронов по подуровням (2.3), составим электронную формулу атома кальция:
Так как последним заполняется s-подуровень, кальций относится к s-семейству.
Пример 3. Какие значения квантовых чисел n, l, ml, ms имеют валентные электроны атома Решение. 1. Электронную формулу атома алюминия составим согласно формуле (2.3):
Известно, что валентными для s и p-элементов являются электроны внешнего слоя. Для атома алюминия это 3s23p1. 2. Состояние электрона в атоме описывается набором четырех квантовых чисел в виде групп символов nlx: а) n - главное квантовое число, определяется по номеру заполненного уровня; б) l - побочное (орбитальное) квантовое число. Для s-подуровня l=0; для р-подуровня l=1; для d-подуровня l=2 и т.д.; х - число электронов на этом подуровне; в) m l– магнитное квантовое число, принимающее следующие значения: г) m s - спиновое квантовое число, принимающее значения ±1/2.
Для определения квантовых чисел необходимо распределить валентные электроны по квантовым ячейкам:
|


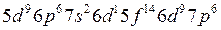 (2.3)
(2.3)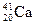 ? Написать электронную формулу рассматриваемого элемента, распределить валентные электроны по квантовым ячейкам.
? Написать электронную формулу рассматриваемого элемента, распределить валентные электроны по квантовым ячейкам.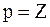 ,
,  .
.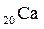
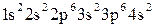 .
.

 3. Валентными у кальция являются внешние 4s2 электроны. Их распределение по квантовым ячейкам: 4s2
3. Валентными у кальция являются внешние 4s2 электроны. Их распределение по квантовым ячейкам: 4s2 ? Напишите электронную формулу элемента.
? Напишите электронную формулу элемента.
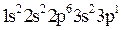 .
.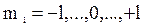 ;
;





