Термохимия
Термохимия изучает тепловые эффекты химических процессов. Протекание химических реакций всегда связано с выделением или поглощением теплоты. Химические реакции, в результате которых выделяется теплота, называются экзотермическими, химические реакции, протекающие с поглощением теплоты, называются эндотермическими. При химических процессах может выделяться или поглощаться не только тепловая, но и другие виды энергии: электрическая, световая, механическая и др. Различные виды энергии, выделяемой или поглощаемой в ходе процесса, пересчитывают на тепловую энергию, выражая ее количество в килоджоулях (кДж). Количество энергии относят к такому числу молей вещества, которое указано в уравнении реакции, и называют его тепловым эффектом (теплотой) Q реакции. Уравнения реакций, в которых указываются тепловые эффекты, называются термохимическими. Так как тепловой эффект зависит от состояния вещества, то в термохимических уравнениях указывают их фазовое состояние. Для реакций, протекающих при постоянном давлении и постоянной температуре, тепловой эффект равен изменению энтальпии с противоположным знаком: Qр =-DН, кДж/моль, а при постоянном объеме он равен изменению внутренней энергии с противоположным знаком: QV =-D U. Тепловой эффект реакции образования одного моля вещества из простых веществ называется теплотой образования DН данного вещества. Энтальпию образования 1 моля сложного вещества из простых веществ, измеренную при температуре 298 К и давлении 101, 325 кПа, называют стандартной энтальпией образования Термохимические расчеты осуществляют, применяя следствие из закона Гесса: тепловой эффект химической реакции DНх.р равен сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ, с учетом коэффициентов перед формулами этих веществ в реакции:
Пример 1. Вычислить тепловой эффект, написать термохимическое уравнение горения 1 моля метана и рассчитать количество теплоты, которое выделится при сгорании 10 л CH4. Решение. Составим термохимическое уравнение реакции
Выпишем стандартные теплоты образования
Тепловой эффект реакции вычислим, используя следствие закона Гесса:
При сжигании 22, 4 л выделяется 802, 2 кДж, при сжигании 10 л выделяется х кДж. Составим и решим пропорцию:
Ответ:
|

 , кДж/моль. Энтальпии простых веществ (О2, Н2, S и т.п.) условно принимают равными нулю.
, кДж/моль. Энтальпии простых веществ (О2, Н2, S и т.п.) условно принимают равными нулю. .
.
 веществ (прил. 3):
веществ (прил. 3): ,
,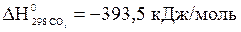 ,
, .
.

 .
. , при сжигании 10 л метана выделяется 360 кДж.
, при сжигании 10 л метана выделяется 360 кДж.


