Химическое сродство
Чтобы понимать химические процессы и управлять ими, необходимо знать ответ на вопрос: каковы движущие силы и критерии самопроизвольных химических процессов. Одной из движущих сил химической реакции является уменьшение энтальпии системы, т. е. экзотермический тепловой эффект реакции. Как показывает опыт, большинство экзотермических (DН< 0) реакций протекают самопроизвольно. Но кроме энтальпийного фактора имеется другая движущая сила самопроизвольного процесса. Это стремление системы к переходу от более упорядоченного состояния к менее упорядоченному. Мерой неупорядоченности состояния системы служит термодинамическая функция, получившая название энтропии. Состояние системы можно характеризовать микросостояниями составляющих ее частиц. Число микросостояний системы называется термодинамической вероятностью системы W. Величина, равная RlnW= S, называется энтропией системы, отнесенной к одному молю вещества. Как и молярная постоянная R, энтропия имеет единицу измерения Дж/(моль× К). Энтропия вещества в стандартном состоянии называется стандартной энтропией Т.к. энтропия является функцией состояния системы, то для вычислений изменения стандартной энтропии химической реакции DSх.р применяют следствие из закона Гесса (с учетом стехиометрических коэффициентов):
Таким образом, в химических процессах проявляются две тенденции: а) стремление к образованию прочных связей между частицами, к возникновению более сложных веществ, сопровождающееся понижением энергии системы (энтальпийный фактор); б) стремление к разъединению частиц, к беспорядку, характеризуемое возрастанием энтропии (энтропийный фактор). Для изохорно-изотермических процессов возможность самопроизвольного протекания определяется через объединяющий эти два фактора изохорно-изотермический потенциал или энергию Гельмгольца:
изменение этой величины Δ F равно
В системах, находящихся при постоянной температуре, самопроизвольно могут протекать только те процессы, которые сопровождаются уменьшением величины F при постоянном объеме. Для изобарно-изотермических процессов энтальпийный и энтропийный факторы объединены функцией, называемой свободной энергией Гиббса или химическим сродством G. Ее рассчитывают как равнодействующую вышеупомянутых факторов реакции:
Свободная энергия Гиббса связана с энтальпией и энтропией следующим соотношением:
Изменение свободной энергии Гиббса Δ G является движущей силой реакции (разностью химических потенциалов) подобно ЭДС в электрических процессах (Δ Е) или перепаду давлений в гидравлических процессах (Δ Р):
и может быть рассчитано по следствию из закона Гесса:
В системах, находящихся при постоянной температуре, самопроизвольно могут протекать только те процессы, которые сопровождаются уменьшением величины G при постоянном давлении. Найдя величину Δ G0х.р, можно вычислить константу химического равновесия реакции Kp, являющуюся количественной характеристикой положения равновесия (предел протекания реакции): Δ G = -RTlnKp. Для окислительно-восстановительных реакций (в том числе и лежащих в основе работы гальванических элементов) через свободную энергию Гиббса можно определить разность окислительно-восстановительных потенциалов или ЭДС элемента (Δ Е): Δ G = -nFΔ Е, где n – число принятых или отданных электронов в окислительно-восстановительном процессе; F – число Фарадея, F = 96483 Кл/моль; Δ Е – разность окислительно-восстановительных потенциалов или ЭДС элемента, В. Пример 2. Может ли реакция I2(K) +H2S (Г)=2HI(Г)+S(K) при стандартных условиях протекать самопроизвольно в прямом направлении. Как скажется повышение температуры на направлении протекания этой реакции? Решение. Выпишем значения
тогда
Положительный знак
|

 .
. .
.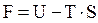 ,
, .
.
 .
.

 для веществ, участвующих в реакции (прил. 3):
для веществ, участвующих в реакции (прил. 3):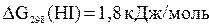 ;
; ,
, .
. означает, что эта реакция при Т=298 К и р=101, 325 кПа самопроизвольно протекать не может. В этой реакции число молей веществ в газообразном состоянии возрастает,
означает, что эта реакция при Т=298 К и р=101, 325 кПа самопроизвольно протекать не может. В этой реакции число молей веществ в газообразном состоянии возрастает,  т.е. в уравнении
т.е. в уравнении  член ТDS-отрицателен. Следовательно, с повышением температуры значение
член ТDS-отрицателен. Следовательно, с повышением температуры значение  будет уменьшаться. Это означает, что повышение температуры будет благоприятствовать протеканию реакции в прямом направлении.
будет уменьшаться. Это означает, что повышение температуры будет благоприятствовать протеканию реакции в прямом направлении.


