Пористые адсорбенты. Капиллярная конденсация
В случае мезопористых адсорбентов процесс взаимодействия адсорбентов с газом осложняется процессом капиллярной конденсации. Капиллярная конденсация – это конденсация парообразного вещества на пористых твердых телах с размером пор от 2 до 200 нм при давлениях, меньших давления насыщенного пара этого вещества над плоской поверхностью (Ps). Возможность капиллярной конденсации следует из уравнения Кельвина (Томсона) для отрицательной кривизны (рис.6). Капиллярные явления, уравнение (9)):
в случае сферической поверхности раздела фаз (уравнение (I)) или из уравнения
в случае цилиндрической поверхности раздела фаз (уравнение (II)). Исходя из соотношений (12) и (13), выразим величины давлений над искривлённой поверхностью:
Соответственно для цилиндрической поверхности раздела фаз имеем:
Из соотношений (12) – (15) следует, что над вогнутыми менисками пар становится насыщенным при Р < Ps, т.е. в капиллярах конденсация пара будет происходить при меньших давлениях пара, чем над жидкостью с плоской поверхностью.
Рис. 6. Изотермы капиллярной конденсации в порах различной формы: Х – количество моль поглощённого вещества в расчёте на единицу массы; а) конусообразная форма пор; б) цилиндрическая форма пор с закрытым концом с одной стороны; в) цилиндрическая форма пор с открытыми концами
Вид изотерм капиллярной конденсации зависит от формы пор. Несмотря на то, что в реальных телах имеются поры различной формы и различных размеров, процесс капиллярной конденсации можно охарактеризовать, используя три основные модели (рис.6): 1) идеальное пористое тело с одинаковыми порами конусообразной формы; 2) идеальное пористое тело с одинаковыми порами цилиндрической формы с закрытым концом; 3) идеальное пористое тело с одинаковыми порами цилиндрической формы с открытыми концами. Конденсация в конусообразных порах (рис.6, а) начинается со дна пор, где кривизна наибольшая. Участки гладкой поверхности и поверхность пор покрываются тонким слоем молекул исследуемого вещества при совместном действии сил поверхностного натяжения и смачивания (участок АО). Затем, как только на дне поры образуется зародыш конденсации, пар начинает конденсироваться, когда давление пара над этой поверхностью достигнет значения Pr согласно (14). Сконденсировавшаяся жидкость продвигается в более широкую часть поры. Это приводит к увеличению радиуса кривизны r и увеличению давления Pr. Следовательно, для того, чтобы пар продолжал конденсироваться, нужно увеличивать внешнее давление (отрезок АВ на рис.6, а). После окончания процесса конденсации количество поглощённого вещества немного увеличивается вплоть до достижения значения P = Ps (участок ВС на рис.6, а). Обратный процесс – деконденсация – описывается той же кривой. В цилиндрических порах с одним открытым концом конденсация начинается также со дна пор, где кривизна сферическая и поэтому наибольшая (рис.6, б). Участки гладкой поверхности и поверхность пор покрываются тонким слоем молекул исследуемого вещества при совместном действии сил поверхностного натяжения и смачивания (участок ОА). Затем, как только на дне поры образуется зародыш конденсации, пар начинает конденсироваться, когда давление пара над этой поверхностью достигнет значения Pr согласно (15). Конденсация на стенках цилиндрической поры уменьшает диаметр поры, что приводит к ее мгновенному заполнению при давлении, отвечающем началу конденсации. Так как в процессе капиллярной конденсации радиус мениска не меняется, цилиндрическая пора, закрытая с одного конца, заполняется при постоянном значении давления (участок АВ на рис.6, б). После окончания процесса конденсации количество поглощённого вещества немного увеличивается вплоть до достижения значения P = Ps (участок ВС на рис.6, б). Процесс конденсации описывается той же кривой. В цилиндрической поре, открытой с обоих концов (рис.6, в), шаровидный мениск в процессе конденсации не образуется. Здесь также вначале участки гладкой поверхности и поверхность пор покрываются тонким слоем молекул исследуемого вещества при совместном действии сил поверхностного натяжения и смачивания (участок ОА на рис.6, в). Затем конденсация начинается на внутренних стенках пор и продолжается до тех пор, пока уменьшающийся радиус цилиндра не достигнет критического значения, при котором капилляр почти мгновенно заполняется жидкостью (отрезок АВ на рис.6, в). После заполнения капилляра на его концах образуются шаровидные мениски, соответствующие P = Pц. После окончания процесса конденсации количество поглощённого вещества немного увеличивается вплоть до достижения значения P = Ps (участок ВС на рис.6, в). При деконденсации вначале испаряется небольшое количество жидкости с гладкой поверхности, затем в устья капилляра вдавливаются шаровидные мениски растущей кривизны, и вся жидкость, которая была сконденсирована в капилляре, испаряется. Таким образом, опорожнение капилляра происходит при меньшем давлении, чем его заполнение, деконденсационная кривая постепенно опускается до точки А (рис.6, в). В результате кривая конденсации не совпадает с кривой деконденсации – появляется петля капиллярно - конденсационного гистерезиса (рис.6, в). На практике изотермы капиллярной конденсации отражают наличие пор различной формы, поэтому вид изотермы зависит от природы исследуемого образца (чаще всего на кривых капиллярной конденсации наблюдается петля гистерезиса). Конденсационную ветвь изотермы капиллярной конденсации (прямой процесс) используют для расчёта пористости адсорбента и нахождения распределения пор по радиусам. Пористость – объём пор единицы массы адсорбента без учёта слоя поглощённого вещества до точки А (рис.6) – рассчитывают по формуле
где Х – удельная величина, равная количеству моль поглощённого вещества на 1 г или 1 кг твёрдого тела; VM – молярный объём сконденсировавшегося пара (м3/моль). Для твёрдых тел, размер пор в которых колеблется в пределах от 2 до 200 нм, предлагается следующее уравнение, связывающее пористость с величиной ε, которая называется адсорбционным потенциалом:
где Vo – предельный объём пор; k` - эмпирическая константа Адсорбционный потенциал определяется по формуле
Очевидно, что зная ε и объём поглощённого вещества, можно определить предельный объём пор Vo, если построить график зависимости ln V от ε (уравнение (17)); отрезок, отсекаемый данной прямой на оси ординат, равен ln Vo). Определив Vo, далее строят интегральную кривую распределения пор по радиусам в координатах Vпор = f(r) по кривой деконденсации (рис.7, а). Эффективный радиус мениска в порах находят по уравнению Томсона (12), так как процесс деконденсации осуществляется для сферичсекой поверхности раздела фаз. Интегральная кривая распределения пор по радиусам позволяет определить объём пор определённого размера. С помощью графического дифференцирования строят дифференциальную кривую распределения пор по радиусам в координатах Δ Vпор / Δ r – rср. По дифференциальной кривой легко определить относительную долю пор любых размеров в данном пористом теле (то есть объем конкретной фракции пор). Например, площадь заштрихованного участка определяет объем пор, размеры которых лежат в пределах от r1 до r2 (рис.7, б). Чем резче выражен максимум и уже дифференциальная кривая, тем меньше различаются поры по размерам. Кроме того, по дифференциальной кривой можно определить, к какому типу относится данное пористое тело.
Рис. 7. Интегральная (а) и дифференциальная кривые распределения пор по радиусам
Пример 1. При изучении адсорбции сернистого ангидрида SO2 на геле кремниевой кислоты при температуре 0 оС были получены следующие экспериментальные данные (табл.2). Таблица 2 Зависимость объёма поглощённого SO2 от давления
1. Постройте изотерму адсорбции (зависимость Х = V/m от Р). 2. Рассчитайте и постройте характеристическую кривую. 3. Определите минимальный и максимальный радиус пор. Решение: 1. Строим изотерму адсорбции (рис. 8). 2. Для построения характеристической кривой предварительно рассчитаем адсорбционный потенциал ε и величину φ. Для определения ε нужно знать давление Ро при различных температурах, для исследованного адсорбата (табл. 3). Таблица 3 Зависимость Ро для SO2 от температуры
Рис. 8. Изотерма адсорбции
Для расчёта ε берём R = 8, 314 Для Р = 17, 6 мм рт. ст. имеем:
Для Р = 20 мм рт. ст. имеем:
Для Р = 31 мм рт. ст. имеем:
Для Р = 47 мм рт. ст. имеем:
Для Р = 60 мм рт. ст. имеем:
Для Р = 67 мм рт. ст. имеем:
Для расчёта φ объём газа в см3 переводим в моль (т.к. в данном случае объёмы пересчитаны на нормальные условия, для нахождения числа моль следует величину объёма V разделить на 22, 4 л = 22, 4·103 см3). Для V = 28, 20 см3 имеем:
Для V = 30, 7 см3 имеем:
Для V = 38, 4 см3 имеем:
Для V = 46, 05 см3 имеем:
Для V = 51, 2 см3 имеем:
Для V = 53, 2 см3 имеем:
Затем, для найденных значений n, используя (10) получим:
где 64 г/моль – молярная масса SO2; 1, 4619 г/см3 – плотность жидкого SO2. Полученные расчётные данные представлены в табл. 4. Таблица 4 Зависимость ε от φ для адсорбции SO2 на силикагеле при 0 оС
Используя данные табл.4 построим характеристическую кривую (рис. 9). В данном случае получилась прямолинейная зависимость, так как интервал давлений мал. 3. Определим минимальный и максимальный радиус пор. С этой целью воспользуемся формулой
полученной из формулы (9). Очевидно, что для получения радиусов капилляров нужно знать поверхностное напряжение жидкого SO2. В табл. 5 представлена зависимость σ от температуры. Таблица 5 Функция σ – t для жидкого сернистого ангидрида
Используя данные табл. 4, табл. 5 и значение
получаем:
Рис. 9. Характеристическая кривая для адсорбции SO2 на силикагеле при 0 оС
|

 . (12)
. (12)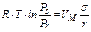 . (13)
. (13)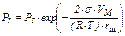 (14)
(14) (15)
(15)
 , (16)
, (16) , (17)
, (17) . (18)
. (18)


 ; Т = 273 К.
; Т = 273 К. .
. .
. .
. .
. .
. .
. .
. .
. .
. .
. .
. .
.
 ;
; ;
; ;
;  ;
; ,
, , (9, а)
, (9, а)

 ,
,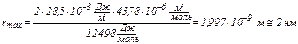 .
.


