ББК 24.1 6 страница
207. Определить молярную массу бензойной кислоты, если известно, что ее раствор в бензоле кристаллизуется при температуре 5, 18 °С. Для бензола Т крист = 5, 5 °С, K кр = 5, 16 К× кг× моль, а для приготовления раствора взято 100 г бензола и 0, 757 г бензойной кислоты. Считать, что в растворе кислота практически не диссоциирована. 208. При какой температуре закипит раствор иодида калия в воде, если для его приготовления взято 300 мл воды и 1, 33 г соли, кажущаяся степень диссоциации 98 %? 209. Относительное понижение давления паров воды над раствором некоторой соли составляет 1 %. Определить, при какой температуре закипит этот раствор. 210. Относительное понижение давления паров над раствором некоторого сильного электролита в воде составляет 1, 5 %. Определить, при какой температуре начнется кристаллизация этого раствора. 211. Раствор, в 100 мл которого находится 2, 3 г вещества, обладает при 298 К осмотическим давлением, равным 618, 5 кПа. Определить молярную массу вещества. 212. В 1 мл раствора содержится 1018 молекул растворенного неэлектролита. Вычислить осмотическое давление раствора при 298 К. 213. В каком отношении должны находиться массы воды и этилового спирта, чтобы при их смешении получить раствор, замерзающий при -20 °С? 214. При 25 °С осмотическое давление некоторого водного раствора 1, 24 МПа. Вычислить осмотическое давление раствора при 0 °С.
4.3. Водородный показатель
Для характеристики кислотно-основных свойств растворов используют водородный показатель рН, равный отрицательному значению десятичного логарифма концентрации ионов водорода. Аналогично рассчитывают гидроксильный показатель рОН, равный отрицательному значению десятичного логарифма концентрации ионов гидроксила:
Концентрации ионов водорода и гидроксила связаны между собой равновесием диссоциации воды: Н2О Û Н+ + ОН-. Константу равновесия называют ионным произведением воды. При 298 К константа равновесия
Прологарифмировав это уравнение, получим рН + рОН = 14. В чистой воде (нейтральная среда) рН = рОН = 7. В кислой среде рН < 7, в щелочной среде рН > 7. Расчет рН в растворах сильных кислот и оснований. Для сильных кислот и щелочей, полностью диссоциированных на ионы, [Н+] = zC к и [ОН-] = zC щ, где С к и С щ - моляльные концентрации кислоты и щелочи соответственно; z - основность кислоты или кислотность основания. Разбавление раствора сильного электролита учитывают в кислой и щелочной среде соответственно по уравнениям рН2 = рН1 + lg n, рН2 = рН1 – lg n, где индекс 1 относится к исходному раствору (до разбавления), индекс 2 – к конечному раствору (после разбавления). В среде, близкой к нейтральной, необходимо принять во внимание диссоциацию воды, в результате которой образуются ионы Н+иОН -.
При смешивании растворов сильных кислот и оснований возможны два варианта: · если смешивают два кислых или два щелочных раствора, т.е. рН1 < 7 и рН2 < 7 или рН2 > 7ирН2 > 7, то
· если смешивают кислый и щелочной растворы, т.е. рН1 < 7 и рН2 > 7, то конечную концентрацию раствора рассчитывают по веществу, взятому в избытке. При избытке кислоты
при избытке щелочи
Расчет рН в растворах слабых кислот и оснований. Диссоциация многих электролитов протекает не полностью. Отношение числа диссоциированных молей к общему числу молей электролита в растворе называют степенью диссоциации. Для его количественного описания используют константу равновесия, называемую константой диссоциации. Для одноосновной кислоты, диссоциирующей по уравнению, НАn Û Н+ + Аn-, где Аn – кислотный остаток, константа диссоциации
Так как [An–] = [H+] и [НAn] = C, то
(4.17)
где С – концентрация слабой кислоты, моль/л. Для растворов слабых оснований
где С – концентрация слабого основания, моль/л. По значению константы диссоциации можно рассчитать степень диссоциации слабого электролита:
Многоосновные кислоты диссоциируют ступенчато, например: Н2S Û НS- + Н + (1-я ступень); НS- Û S2- + Н+ (2-я ступень). При расчетах рН обычно учитывают только первую ступень диссоциации, пренебрегая второй и третьей ступенями. Таким образом, уравнения (4.16) и (4.18) справедливы и для многоосновных кислот при использовании первой константы диссоциации Kd 1. Константы диссоциации некоторых слабых кислот и оснований даны в прил.1. Пример 10. Вычислить рН раствора серной кислоты концентрацией 0, 3 % (d = 1, 0 г/см3). Решение. 1. Перейдем к моляльной концентрации серной кислоты. Для этого выделим мысленно 100 г раствора, тогда масса серной кислоты составит 0, 3 г, а масса воды – 99, 7 г. По уравнению (4.4) вычислим моляльную концентрацию:
2. Согласно уравнению диссоциации H2SO4 ® 2H+ + SO42-, из 1 моль серной кислоты образуется 2 моль H+, следовательно, 3. По уравнению (4.13) вычислим рН = –lg[H+] = –lg0, 062 = = 1, 21. Пример 11. Вычислить рН раствора гидроксида бария концентрацией 0, 0068 экв/л. Решение. 1. По уравнению диссоциации Ba(OH)2 ® Ba2+ + + 2 OH- из 1 моль гидроксида бария образуется 2 моль гидроксил-ионов:
2. По уравнению (4.13) найдем рOН = –lg[OH-] = –lg0, 0068 = = 2, 17 и вычислим рН = 14 - рОН = 14 – 2, 17 = 11, 83. Пример 12. Определить рН, если раствор одноосновной кислоты с рН = 5, 5 разбавлен в 100 раз. Решение. По уравнению (4.14) найдем концентрацию ионов водорода в конечном растворе
и вычислим рН2 = –lg[H+]2 = –lg1, 15× 10-7 = 6, 9. Пример 13. Определить значение рН при смешении 10 л раствора с рН1 = 2 и 17 л раствора с рН2 = 4. Решение. По уравнению (4.15) найдем концентрацию ионов водорода в конечном растворе
и вычислим рН3 = –lg[H+]3 = –lg(4, 6× 10-3) = 2, 33. Пример 14. Смешали 250 мл раствора с рН = 3 и 300 мл раствора гидроксида калия концентрацией 0, 001 моль/л. Определить рН полученной смеси. Решение. Обозначим объемы смешиваемых растворов V 1 и V 2 соответственно. Найдем число молей OH-:
Согласно уравнению диссоциации KOH ® K+ + OH-, Найдем число молей H+:
Очевидно, что в избытке находятся гидроксил-ионы. Их остаточную концентрацию в полученном растворе найдем по уравнению
Вычислим рН3 = 14 + lg[OH-]3 = 14 + lg(9, 1× 10-5) = 9, 96. Пример 15. Найти рН раствора борной кислоты с мольной долей 0, 0025 (d р-р = 1, 0 г/см3). Решение. 1. выделим мысленно 1 кг раствора. Запишем
где индекс 1 относится к растворителю, т.е. к воде, а индекс 2 – к растворенному веществу, т.е. к H3BO3. Так как M 1 = 18 г/моль, М 2 = 61, 8 г/моль и
то
Вычислим
2. Так как плотность раствора 1 г/см3, то его объем соответствует 1 л, и молярная концентрация численно равна количеству вещества борной кислоты, т.е. СМ (Н3ВО3) = 0, 138 моль/л. 3. Диссоциация борной кислоты по первой ступени протекает по реакции H3BO3 ® H+ + H2BO3-, для которой константа диссоциации Kd 1 = 7, 1× 10-10. Второй и третьей ступенями диссоциации борной кислоты пренебрегаем. 4. В соответствии с уравнениями (4.17) и (4.13) вычислим
рН = –lg[H+] = –lg(9, 9× 10-6) = 5. Пример 16. Сколько граммов бутиламина содержится в 1 л его раствора, имеющего рН = 11, 5? Решение. Гидрат бутиламина диссоциирует как основание по уравнению C4H9NH2× H2O Û C4H9NH3+ + OH-. Константа диссоциации Kd = 4, 57× 10-4, p Kd = 3, 340, гидроксильный показатель рОН = 14 – рН = 2, 5. По формуле (4.18) найдем молярную концентрацию бутиламина lg CМ = p Kd – 2pOH = 3, 34 – 2× 2, 5 = –1, 66; CМ = 10-1, 66 = 0, 022 моль/л. Масса бутиламина, содержащаяся в 1 л раствора, Сг/л = CМM, где М – молярная масса бутиламина 73 г/моль. Тогда С г/л =0, 022× 73 = 1, 6 г/л. Задание IV. Определить pH предложенного раствора сильного электролита (табл.4.2).
Таблица 4.2
Задание V. Определить pH следующих растворов. 265. Раствор гидроксида бария концентрацией 0, 1 моль/л, если к 1 л этого раствора добавили 7, 1 г гидроксида натрия. 266. Раствор серной кислоты концентрацией 0, 1 моль/л, если к 1 л этого раствора добавили 7, 1 г гидроксида бария. 267. Раствор после выщелачивания боксита по следующим данным: масса руды 1 т; ω (Al2O3∙ Н2O) = 80 %; V (NaOH) = 3, 1 м3; ω (NaOH) = 15 %. 268. 10-процентный раствор соляной кислоты (d = 1, 047 г/мл) при условии, что к 20 л этого раствора прибавили 5 м3 воды, содержащей гидроксид кальция концентрацией 0, 02 экв/л. 269. Раствор, содержащий 4 г KOH и 5 г NaOH в 1 л воды. 270. Раствор, содержащий 0, 005 моль/л серной кислоты и 0, 006 моль/л соляной кислоты. 271. Раствор после выщелачивания по реакции Li2O∙ Al2O3∙ 4SiO2 + H2SO4 → Li2SO4 + Al2O3∙ 4SiO2∙ H2O↓, если масса руды 1 т, w(Li2O∙ Al2O3∙ 4SiO2) = 70 %; V (H2SO4) = 4 м3; w(H2SO4) = = 5 %, d = 1, 032 г/мл. 272. Раствор после выщелачивания руды, если масса руды 1 т, в руде содержится 6 % Cu4(SO4)(OH)6; w(H2SO4) = 3 %, d = 1, 03 г/мл, V (H2SO4) = 3 м3. 273. Раствор, полученный при разбавлении 20 л 10 % соляной кислоты (d = 1, 047 г/мл) пятью кубометрами воды. 274. Рассчитать рН раствора азотнокислых стоков, если 10 л 5-процентной азотной кислоты сброшены в резервуар емкостью 5 м3. 275. Раствор соляной кислоты, если к 100 мл этого раствора, содержащего 5 мг HCl, прибавили 5 мг нитрата свинца (II). 276. Раствор объемом 10 м3, содержащий по 50 г серной и дихромовой кислот. 277. Щелочные стоки объемом 5 л, содержащие 2 мэкв щелочи. 278. Раствор дихромовой кислоты, если в нем содержится 2 мг/мл Cr (VI). Задание VI. Определить pH и степень диссоциации предложенного раствора слабого электролита при температуре 25 °С (табл.4.3.)
Таблица 4.3
Окончание табл.4.3
Задание VII. По заданному значению pH (табл.4.4) определить концентрацию предложенного раствора электролита при температуре 25 °С и выразить ее всеми возможными способами (считать, что плотность растворов 1 г/см3).
Таблица 4.4
Задание VIII. По значению pH определить концентрацию предложенного раствора слабого электролита и выразить ее всеми возможными способами (табл.4.5).
Таблица 4.5
Окончание табл.4.5
|

 . (4.13)
. (4.13) .
. (4.14)
(4.14) .
. ; (4.15)
; (4.15) .
.
 .
. . (4.16)
. (4.16) ;
; ,
, , (4.18)
, (4.18)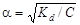 .
.



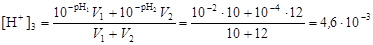





 ,
, Þ
Þ  ,
, .
.




