ББК 24.1 5 страница
100. К 200 мл 0, 7 н. раствора серной кислоты прибавили 300 г воды. Рассчитать конечную концентрацию серной кислоты в граммах на литр. 101. Смешали 20 мл 0, 5 н. раствора соляной кислоты и 10 мл 0, 2 н. раствора гидроксида бария. Какое вещество и в каком количестве будет находиться в растворе в избытке? 102. Раствор хлорида бария содержит 2, 3 г бария. Сколько миллилитров 0, 5 н. раствора серной кислоты потребуется для осаждения всего бария в виде сульфата? 103. Сколько и какого вещества останется в избытке, если к 75 мл 0, 3 н. раствора серной кислоты прибавить 125 мл 0, 2 н. раствора калиевой щелочи? 104. Для осаждения в виде хлорида всего серебра, содержащегося в 100 мл раствора нитрата серебра, потребовалось 50 мл 0, 2 н. раствора соляной кислоты. Какова нормальность раствора нитрата серебра, и какая масса хлорида серебра выпала в осадок? 105. На нейтрализацию 31 мл 0, 16 н. раствора щелочи требуется 217 мл раствора серной кислоты. Чему равна нормальность раствора серной кислоты? 106. Какой объем 0, 3 н. раствора кислоты требуется для нейтрализации раствора, содержащего 0, 32 г гидроксида натрия в 40 мл? 107. На нейтрализацию 1 л раствора, содержащего 1, 4 г гидроксида калия, требуется 50 мл раствора кислоты. Вычислить нормальность раствора кислоты. 108. Какая масса азотной кислоты содержалась в растворе, если на нейтрализацию его потребовалось 35 мл 0, 4 н. раствора гидроксида натрия? 109. Сколько миллилитров 1 н. раствора едкого натра потребуется для полной нейтрализации 300 мл 0, 1 М раствора серной кислоты? 110. Смешали 1 л раствора соляной кислоты (концентрация 20 %, плотность 1, 098 г/см3) и 1 л раствора соляной кислоты (концентрация 12, 5 %, плотность 1, 06 г/см3). Какой молярной концентрации раствор получится после смешивания? 111. Сколько миллилитров 0, 1 н. едкого натра (NaOH) потребуется для осаждения меди в виде гидроксида из 20 мл раствора сульфата меди, в 1 л которого содержится 10 г меди? 112. Сколько миллилитров соляной кислоты (концентрация 10 %, плотность 1, 047 г/ см3) потребуется для нейтрализации раствора, содержащего 8, 5 г гидроксида бария? 113. Сколько миллилитров раствора соды, содержащего в 1 л 21, 2 г соли, надо добавить к 30 мл 0, 2 н. раствора хлорида кальция для полного осаждения кальция в виде карбоната? 114. Сколько граммов гидроксида железа выпадет в осадок, если к 500 мл 0, 2 н. раствора хлорида железа (III) добавить избыток щелочи? 115. В каком объемном отношении надо смешать растворы гидроксида бария с концентрацией 95, 5 г/л и 0, 5 н. соляной кислоты для получения раствора с нейтральной средой? 116. На нейтрализацию 20 мл раствора едкого кали потребовалось 13 мл 0, 2 н. раствора кислоты. Сколько граммов едкого кали содержится в 1 л раствора? 117. Сколько миллилитров раствора нитрата серебра, содержащего 5 г/л серебра, надо добавить к 10 мл 0, 2 н. раствора хлорида натрия, чтобы полностью удалить из раствора ионы хлора? 118. Сколько миллилитров 2 н. серной кислоты потребуется для превращения 1, 56 г гидроксида алюминия в сульфат алюминия? 119. Сколько граммов карбоната кальция можно растворить в 100 мл соляной кислоты (концентрация 20 %, плотность 1, 1 г/см3)? Вычислить объем, который займет выделившийся газ при нормальных условиях. 120. К 5 г цинка прибавили 100 мл 10, 2-процентной соляной кислоты (плотность раствора 1, 05 г/см3). Какое вещество и в каком количестве осталось в избытке? Вычислить объем водорода, выделившегося при 20 º С и 750 мм рт. ст. 121. На нейтрализацию 20 мл раствора гидроксида калия (концентрация 5, 66 %, плотность 1, 053 г/см3) пошло 12, 1 мл раствора серной кислоты плотностью 1, 052 г/см3. Определить процентную концентрацию раствора серной кислоты. 122. Какое количество миллилитров 0, 5 н. раствора сульфата натрия надо долить к 100 мл раствора хлорида бария (концентрация 16 %, плотность 1, 156 г/см3), чтобы полностью осадить сульфат-ион? 123. На нейтрализацию 50 мл раствора фосфорной кислоты плотностью 1, 01 г/см3 израсходовано 31, 2 г 1 н. раствора гидроксида натрия плотностью 1, 04 г/см3. Определить процентную концентрацию фосфорной кислоты. 124. 10 г сплава меди с цинком обработали соляной кислотой. При этом выделилось 570 мл водорода, измеренных при температуре 27 º С и давлении 105 Па. Определить состав сплава и выразить его в массовых и мольных долях. 125. При растворении 15 г сплава серебра с алюминием раствором едкого натра выделилось 13 мл водорода, измеренного при температуре 57 º С и давлении 15× 105 Па. Определить состав сплава и выразить его в массовых и мольных долях. 126. При растворении в азотной кислоте 5 г сплава меди и золота выделилось 0, 99 мл оксида азота (II), измеренных при температуре 37 º С и давлении 1, 2× 105 Па. Определить состав сплава и выразить его в массовых и мольных долях. 127. Для нейтрализации 20 мл 0, 1 н. раствора кислоты потребовалось 8 мл раствора гидроксида натрия. Сколько граммов NaOH содержит 1 л этого раствора? 128. Какой объем 0, 2 н. раствора кислоты требуется для нейтрализации раствора, содержащего 0, 51 г гидроксида калия в 30 мл? 129. Сколько и какого вещества останется в избытке, если к 150 мл 0, 4 н. раствора соляной кислоты прибавить 250 мл 0, 2 н. раствора гидроксида натрия? 130. Смешали 100 мл 1, 5 н. раствора и 100 мл 0, 5 н. раствора серной кислоты. Рассчитать молярность полученного раствора. 131. К 100 мл раствора едкого натра (концентрация 10 %, плотность 1, 109 г/см3) прибавили 200 мл раствора NaOH (концентрация 20 %, плотность 1, 219 г/см3). Рассчитать нормальность полученного раствора. 132. К 500 мл раствора хлорида натрия (концентрация 6 %, плотность 1, 04 г/см3) прибавили 1 л раствора хлорида калия концентрацией 8 % и плотностью 1, 05 г/см3. Рассчитать молярную концентрацию хлорид-иона в растворе после смешения. 133. Смешали два раствора нитрата натрия концентрацией 0, 8 и 0, 2 моль/л в пропорции 2: 1. Рассчитать молярную концентрацию полученного раствора. 134. Определить эквивалентную массу кислоты, если на нейтрализацию раствора, содержащего 0, 63 г кислоты, израсходовано 20 мл 0, 5 н. раствора щелочи. 135. Смешали 2 л раствора сульфата меди (II) концентрацией 2 % и плотностью 1, 02 г/см3 и 1 л раствора хлорида меди (II) концентрацией 0, 1 н. Рассчитать молярную концентрацию меди в полученном растворе. 136. К 50 мл раствора NaCl концентрацией 10 г/л прибавили 100 мл раствора NaCl концентрацией 2 г/л. Рассчитать молярную концентрацию полученного раствора. 137. К 100 л раствора соли железа с содержанием по железу 5 г/л прибавили 50 л раствора нитрата железа (III) концентрацией 0, 3 моль/л. Рассчитать молярную концентрацию железа в полученном растворе. 138. На нейтрализацию раствора, содержащего 4, 05 г кислоты, израсходовано 40 мл раствора едкого натра (NaOH) концентрацией 10 % и плотностью 1, 109 г/см3. Определить эквивалентную массу кислоты. 139. К 50 л раствора фосфорной кислоты концентрацией 8 % и плотностью 1, 042 г/см3 прибавили 2 л фосфата натрия концентрацией 5 г/л. Рассчитать молярную концентрацию фосфат-иона в полученном растворе. 140. Смешали 54 мл раствора NaOH концентрацией 0, 5 % и плотностью 1 г/см3 и 10 мл 2-процентного раствора NaOH плотностью 1, 02 г/см3. Рассчитать концентрацию полученного раствора (в процентах). 141. Смешали 120 л раствора с содержанием никеля 0, 8 моль/л, 500 л раствора с содержанием никеля 1 г/л и 50 л раствора (концентрация NiSO4 14 %, плотность 1, 158 г/см3). Рассчитать молярную концентрацию никеля в полученном растворе. 142. На нейтрализацию 10 мл раствора серной кислоты концентрацией 22 % и плотностью 1, 155 г/см3 потребовалось 50 мл раствора щелочи концентрацией 41, 6 г/л. Определить эквивалентную массу щелочи. 143. Смешали 4 мл серной кислоты (концентрация 40 %, плотность 1, 303 г/см3) и 200 мл серной кислоты концентрацией 0, 001 моль/л. Рассчитать нормальную концентрацию полученного раствора. 144. Смешали 8 л раствора соляной кислоты концентрацией 4 моль/л и 11 л раствора той же кислоты концентрацией 2 г/л. Рассчитать концентрацию полученного раствора в граммах на литр. 145. Сколько известняка с содержанием карбоната кальция 70 % потребуется для полной нейтрализации 10 л серной кислоты концентрацией 5 г/л? 146. Смешали 7 л раствора магния концентрацией 0, 1 моль/л и 5 л раствора соли кальция концентрацией по кальцию 4 г/л. Рассчитать общее содержание металлов в растворе (в молях на литр). 147. К раствору, содержащему 5 г сульфата цинка, объемом 2 л добавили 3 л раствора сульфата меди (II) концентрацией 0, 3 моль/л. Рассчитать молярную концентрацию сульфат-иона в полученном растворе. 148. Смешали растворы нитрата аммония концентрацией 0, 3 моль/кг и 0, 08 моль/л в соотношении 1: 3. Рассчитать моляльную концентрацию полученного раствора. Плотность всех растворов принять равной 1 г/см3. 149. К раствору объемом 30 мл, содержащему 10 г серной кислоты в 100 мл раствора, прибавили 40 мл раствора NaOH, содержащего 9 г гидроксида натрия в 100 мл раствора. Найти молярную концентрацию вещества, которое останется в избытке. 150. Смешали раствор нитрата серебра (концентрация 1 %, плотность 1, 01 г/см3) и раствор соляной кислоты (концентрация 5 %, плотность 1, 02 г/см3) в соотношении 3: 4. Рассчитать молярную концентрацию нитрат-иона в полученном растворе. 151. Какой объем раствора серной кислоты (концентрация 10 %, плотность 1, 07 г/см3) потребуется для полной нейтрализации 0, 5 л раствора NaOH концентрацией 16 г/л? 152. Смешали 10 мл раствора HCl (концентрация 10 %, плотность 1, 047 г/см3) и 10 мл раствора HCl (концентрация 6 %, плотность 1, 028 г/см3). Рассчитать массовую долю и молярную концентрацию соляной кислоты в полученном растворе. 153. Из раствора нитрата серебра (концентрация 2 %, плотность 1, 015 г/см3) по реакции с хлоридом натрия образуется 14, 35 г хлорида серебра. Вычислить исходный объем раствора нитрата серебра. 154. Смешали 1 л 1 М раствора CuSO4 и 2 л 0, 5 М раствора CuSO4. Рассчитать содержание меди в полученном растворе в граммах на литр. 155. Сколько миллилитров 0, 5 н. раствора сульфата натрия нужно добавить к 100 мл раствора хлорида бария (концентрация 16 %, плотность 1, 156 г/см3), чтобы полностью осадить сульфат-ионы? 156. Металл вытеснил из 100 мл соляной кислоты 348 мл водорода, измеренного при 20 °С и 99, 5 кПа. Рассчитать нормальную концентрацию хлорида металла в полученном растворе.
4.2. Коллигативные свойства растворов
Свойства растворов (температура замерзания и кипения, давление насыщенного пара, осмотическое давление) зависят от природы растворителя и концентрации раствора и называются коллигативными свойствами, так как не зависят от природы растворенного вещества. Закон Рауля. Закон формулируется следующим образом: относительное понижение давления насыщенного пара растворителя над раствором равно молярной доле растворенного вещества в растворе. Согласно закону, понижение парциального равновесного давления насыщенного пара растворителя над раствором является линейной функцией мольной доли растворенного вещества в растворе:
или
где Изменение температур фазовых переходов растворов. Повышение температуры кипения
где Изменение температуры кристаллизации
где Осмотическое давление. Процесс самопроизвольного перехода растворителя в раствор через полупроницаемую мембрану называется осмосом. Давление, которое нужно приложить к раствору, чтобы осмос прекратился, называется осмотическим давлением, которое можно вычислить по формуле
где Для электролитов необходим поправочный множитель i, названный изотоническим коэффициентом:
Изотонический коэффициент – показатель увеличения (уменьшения) числа частиц вследствие диссоциации (ассоциации). При i > 1 протекает процесс диссоциации, при i < 1 – процесс ассоциации. Численное значение изотонического коэффициента позволяет вычислить степень диссоциациии ассоциации. Соответственно
где z – число частиц, получающихся из одной частицы при диссоциации; z ¢ – число частиц, объединяющихся в одну при ассоциации. Пример 6. относительное понижение упругости пара над раствором тростникового сахара (С12Н22О11) в воде составляет 2 %. Определить осмотическое давление этого раствора при температуре 47 º С. Плотность раствора 1, 15 г/см3. Определить изменение температуры плавления и кристаллизации, если K эб = 0, 52 K·кг/моль, K кр = = 1, 86 K·кг/моль, Решение. Из закона Рауля (4.7), (4.8) следует, что мольная доля сахара в растворе составляет 0, 02. По формуле (4.9) определим повышение температуры кипения раствора:
По формуле (4.10) понижение температуры замерзания раствора:
вычислим осмотическое давление по формуле (4.11): Пример 7. Раствор магния в олове содержит 0, 833 г магния в 100 г олова. Температура плавления олова 505 К, а теплота плавления 7200 Дж/моль. Определить температуру начала кристаллизации этого раствора. Решение. определим мольную долю х 2 магния в олове:
по уравнению (4.10) вычислим температуру кристаллизации расплава:
Пример 8. В системе свинец (II)-серебро (I) при Т = 1490 К закон Рауля справедлив для растворов, содержащих менее 18 % свинца. Давление насыщенного пара над чистым серебром 7, 47 Па. Вычислить давление пара серебра над раствором, содержащим 17, 5 % свинца. Решение. выделим мысленно 100 г расплава и примем их за 100 %, тогда
По уравнению (4.8) вычислим давление пара серебра над расплавом
Пример 9. Давление насыщенного пара над раствором, содержащим 5 г едкого натра в 180 г воды, при 100 º С составляет 0, 99·105 Па. Давление насыщенного пара над чистой водой при 100 º С составляет 1, 01·105 Па. Определить состояние едкого натра в растворе. Решение. Состояние едкого натра в растворе можно оценить по величине изотонического коэффициента i. По закону Рауля (4.8)
Из уравнения (4.12) вычислим
полученное значение i > 1 указывает на наличие диссоциации NaOH. Кажущаяся степень диссоциации
Задание III. Решить задачи. 157. Определить осмотическое давление раствора, содержащего 30 г глицерина в 120 г воды, если плотность этого раствора близка к единице, а температура 27 °С. 158. Определить осмотическое давление раствора хлорида натрия в воде концентрацией 5 %, если плотность раствора 1, 04 г/см3, температура 17 °С. Кажущаяся степень диссоциации 95 %. 159. К 100 мл 0, 5 М водного раствора сахарозы С12Н22О11 добавлено 300 мл воды. Чему равно осмотическое давление полученного раствора при 25 °С? 160. При 293 K давление насыщенного пара над водой равно 2, 34 кПа. Сколько граммов глицерина С3Н5(ОН)3 надо растворить в 180 г воды, чтобы понизить давление пара на 133, 3 Па? 161. При растворении 13 г неэлектролита в 400 г диэтилового эфира (С2Н5)2О температура кипения раствора повысилась на 0, 453 K. Определить молярную массу растворенного вещества. 162. В 60 г бензола растворено 2, 09 г некоторого вещества, содержащего 50, 69 % С, 4, 23 % Н, 45, 08 % О. Установить молекулярную формулу вещества. Чистый бензол кристаллизуется при 5, 5 °С. 163. Температура кипения водного раствора сахарозы С12Н22О11 101, 4°С. Вычислить молярную концентрацию и массовую долю сахарозы в растворе. При какой температуре этот раствор замерзает? 164. Определить осмотическое давление раствора хлорида бария в воде, если его концентрация 5 %, плотность 1, 08 г/см3, температура 7 °С, кажущаяся степень диссоциации 97 %. 165. Определить кажущуюся степень диссоциации хлорида калия в его 0, 1 н. водном растворе, если при температуре 27 °С осмотическое давление раствора 4, 72× 105 Па. 166. Осмотическое давление гипертонического раствора (водный раствор хлорида натрия концентрацией 10 %) при температуре 20 °С составляет 84× 105 Па. Найти кажущуюся степень диссоциации соли в этом растворе, если его плотность 1, 1 г/см3. 167. Установить концентрацию раствора сульфата натрия в воде и выразить ее всеми способами, если известно, что осмотическое давление раствора при температуре 15 °С составляет 32, 5× 105 Па, кажущаяся степень диссоциации 91 %. 168. Водный раствор соли хрома (III) имеет осмотическое давление 18, 1× 105 Па, плотность раствора 1, 06 г/см3. Определить концентрацию раствора и выразить ее всеми способами, если соль диссоциирована нацело. 169. Сколько граммов хлорида кальция надо растворить в 1 л воды, чтобы полученный раствор при температуре 27 °С имел осмотическое давление 23, 7× 105 Па? Кажущаяся степень диссоциации 95 %. 170. Сколько граммов сульфата меди (II) надо растворить в 100 мл воды, чтобы при температуре 7 °С полученный раствор имел осмотическое давление 16× 105 Па? Кажущаяся степень диссоциации 87 %. 171. Определить концентрацию хлорид-ионов в растворе хлорида ртути (II), если при температуре 17 °С и концентрации раствора 0, 1 моль/л его осмотическое давление 2, 62× 105 Па. 172. Раствор роданида железа (III) в воде с концентрацией 0, 5 моль/л при температуре 27 °С имеет осмотическое давление 15, 5× 105 Па. Определить концентрацию роданид-ионов в данном растворе. 173. Найти давление паров воды над раствором хлорида натрия концентрацией 5 %, если температура раствора 20 °С, кажущаяся степень диссоциации 98 %, 174. Определить молярную концентрацию раствора карбамида, если при температуре 35 °С давление паров воды над раствором оказалось на 2 % ниже, чем над индивидуальной водой ( 175. Вычислить кажущуюся степень диссоциации сульфата калия в его водном растворе концентрацией 3 %, если относительное понижение давления паров воды над раствором составляет 9, 23× 10-3Па. 176. Рассчитать давление паров воды над 0, 5-процентным раствором хлорида бария при 15 °С, если кажущаяся степень диссоциации 96 %, 177. Определить концентрацию сульфата цинка в водном растворе, если относительное понижение давления пара над этим раствором 0, 1 %, и соль диссоциирована нацело. 178. Какова концентрация хлорида алюминия в растворе, если относительное понижение давления пара над раствором 0, 16 %, степень диссоциации соли 100 %? 179. Осмотическое давление раствора хлорида натрия при температуре 20 °С составляет 8, 4× 105 па. Определить давление паров воды над этим раствором, если плотность раствора 1, 05 г/см3, кажущаяся степень диссоциации соли 92 %, 180. Раствор хлорида калия в воде имеет осмотическое давление 9, 44× 105 Па. Определить давление паров воды над этим раствором, если его температура 27 °С, плотность раствора 1, 07 г/см3, кажущаяся степень диссоциации соли 92 %, 181. Определить давление паров воды над раствором глицерина С3Н5(ОН)3, если в 100 г воды растворено 20 г глицерина, плотность раствора 1, 1 г/см3, 182. Определить концентрацию раствора сульфата натрия в воде, если при температуре 22 °С давление паров воды над этим раствором 2, 61× 103 Па, кажущаяся степень диссоциации 95, 7 %, 183. При какой температуре закипит водный раствор хлорида меди (II) концентрацией 2 %, если кажущаяся степень диссоциации 97 %? 184. Найти температуру кипения раствора сульфата натрия в воде, если при 27 °С раствор этой соли имеет осмотическое давление 7, 16× 105 Па, плотность 1, 06 г/см3. Кажущаяся степень диссоциации 96 %. 185. Какой должна быть концентрация раствора хлорида цинка в воде, чтобы этот раствор закипал при температуре 100, 52 °С? Соль диссоциирована на 100 %. Выразить концентрацию раствора (плотность 1, 04 г/см3) всеми способами. 186. Определить кажущуюся степень диссоциации нитрата натрия, если этот раствор кипит при температуре 100, 1 °С, а в 100 г воды растворено 0, 85 г соли. 187. Раствор хлорида алюминия в воде концентрацией 0, 2 моль/кг кипит при температуре 100, 406 °С. Найти осмотическое давление этого раствора при температуре кипения, если его плотность 1, 06 г/см3. 188. В 100 г воды содержится 0, 58 г хлорида натрия. При какой температуре закипит этот раствор, если кажущаяся степень диссоциации 96 %? 189. Какова кажущаяся степень диссоциации бромида калия в растворе концентрацией 2 %, если он закипает при 100, 17 °С. 190. Определить эбуллиоскопическую постоянную этилового спирта, если известно, что раствор, содержащий 0, 506 г йодноватой кислоты и 31, 8 г этанола, кипит при температуре 78, 464 °С. В данных условиях кислота диссоциирована на 32, 6 %, а температура кипения чистого этанола 78, 3 °С. 191. Вычислить относительное понижение давления водяного пара над раствором хлорида кобальта (II), если при кажущейся степени диссоциации 93 % раствор кипит при температуре 100, 30 °С. 192. Определить, сколько граммов глицерина надо добавить к 100 г воды, чтобы получившийся раствор не замерзал до температуры –3, 2 °С. 193. При какой температуре начнется кристаллизация воды из раствора хлорида калия концентрацией 3 %, если кажущаяся степень диссоциации 89 %? 194. Определить кажущуюся степень диссоциации сульфата магния в его 0, 1 н. растворе плотностью 1, 02 г/см3, если этот раствор начинает кристаллизоваться при температуре –0, 153 °С. 195. При какой температуре начнет кристаллизоваться раствор сульфата железа (II) концентрацией 2 %, если его температура кипения 100, 136 °С? 196. При какой температуре закипит раствор глицерина в воде, если он кристаллизуется при температуре –1, 5 °С? 197. Кажущаяся степень диссоциации некоторой соли, диссоциирующей на три иона, составляет 97 %. Определить, при какой температуре начнет кристаллизоваться раствор этой соли в воде, если он закипает при температуре 100, 2 °С. 198. Относительное понижение давления паров воды над раствором сульфата калия концентрацией 3 % составляет 9, 23× 10-3. Определить, при какой температуре начнется кристаллизация воды из этого раствора. 199. Раствор хлорида калия в воде концентрацией 0, 8 % и плотностью 1, 02 г/см3 при температуре 27 °С имеет осмотическое давление 5, 13× 105 Па. Определить, при какой температуре начнется кристаллизация этого раствора. 200. Температура кристаллизации бензола +5, 5 °С, а раствора, содержащего 0, 2242 г камфары в 30, 55 г бензола, +5, 254 °С. Определить молярную массу камфары, если константа кристаллизации бензола 5, 16 K× кг/моль. 201. Раствор некоторого органического вещества в этиловом спирте закипает при температуре 78, 41 °С. Определить его молярную массу, если для приготовления раствора было взято 2 г этого вещества, 48 г этилового спирта, температура кипения которого 78, 3 °С, K эб = 1, 19 К× кг/моль. 202. Сколько граммов хлористого натрия надо добавить к 100 г воды, чтобы получившийся раствор не замерзал до температуры –1, 8 °С? Считать, что соль диссоциировала на 100 %. 203. Сколько сахара С12Н22О11 надо растворить в 200 г воды, чтобы полученный раствор кипел при температуре 100, 3 °С? 204. Сколько граммов хлорида бария, диссоциирующего нацело, надо растворить в 1 л воды, чтобы получившийся раствор замерзал при температуре –3, 2 °С? 205. Осмотическое давление раствора глицерина в воде при температуре 7 °С составляет 5, 3× 105 Па. Определить при какой температуре закипит этот раствор, если его плотность 1, 02 г/см3. 206. Определить степень диссоциации бензойной кислоты С6Н5СООН, если раствор ее в бензоле кристаллизуется при температуре 5, 32 °С. Температура кристаллизации индивидуального бензола 5, 5 °С, K кр = 5, 16 К× кг/моль, а для приготовления раствора взято 62, 5 г бензола и 0, 26 г бензойной кислоты.
|

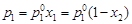 (4.7)
(4.7) (при n 2 < < n 1), (4.8)
(при n 2 < < n 1), (4.8) - давление насыщенного пара растворителя над раствором;
- давление насыщенного пара растворителя над раствором; 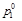 - давление насыщенного пара над индивидуальным растворителем; х 1 и х 2– мольные доли растворителя и растворенного вещества в растворе.
- давление насыщенного пара над индивидуальным растворителем; х 1 и х 2– мольные доли растворителя и растворенного вещества в растворе.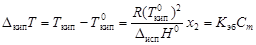 , (4.9)
, (4.9)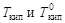 - соответственно температуры кипения раствора и индивидуального растворителя; Сm – моляльная концентрация растворенного вещества, моль/кг; K эб – эбуллиоскопическая константа растворителя,
- соответственно температуры кипения раствора и индивидуального растворителя; Сm – моляльная концентрация растворенного вещества, моль/кг; K эб – эбуллиоскопическая константа растворителя, 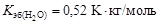 .
.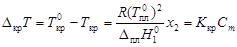 , (4.10)
, (4.10) - соответственно температуры кристаллизации раствора и чистого растворителя; Сm – моляльная концентрация растворенного вещества; K кр – криоскопическая постоянная растворителя,
- соответственно температуры кристаллизации раствора и чистого растворителя; Сm – моляльная концентрация растворенного вещества; K кр – криоскопическая постоянная растворителя, 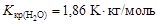 .
.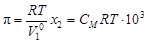 , (4.11)
, (4.11)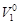 – объем 1 моль растворителя, м3.
– объем 1 моль растворителя, м3.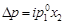 ; (4.12)
; (4.12)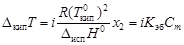 ;
;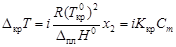 ;
; .
.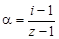 ;
; 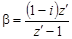 ,
, ;
;  ;
; 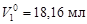 .
.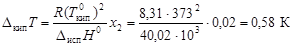 .
.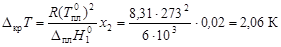 .
. .
.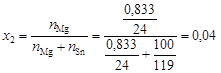 .
.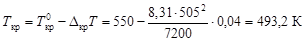
 . мольная доля свинца в сплаве
. мольная доля свинца в сплаве .
.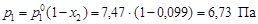 .
.
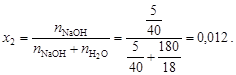

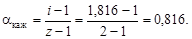
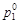 =2, 3× 105 Па.
=2, 3× 105 Па. = 1, 683× 105 Па.
= 1, 683× 105 Па.


