Теоретические основы процесса. ?язь Энергия связи, кДж/моль Н-Н Салкан – С алкан Салкан – Сарен Сарен – Сарен Салкан – Н
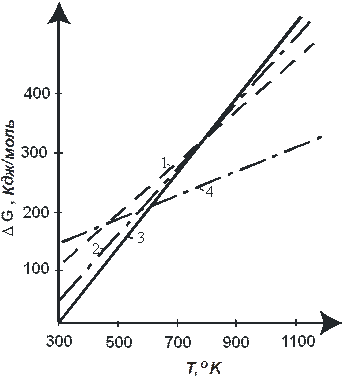
Термодинамика процесса. При температурах пиролиза (700-850оС) наиболее значительную часть химических превращений составляет термический распад углеводородов; одновременно идут также реакции синтеза: полимеризация, конденсация, гидрирование, алкилирование. При оценке возможных термических превращений важную роль играет термодинамическая стабильность углеводородов сырья, а также получающихся в процессе алкенов. Как известно, термодинамическая стабильность соединений и направление их взаимных превращений определяются изменением энергии Гиббса. На рис. 3.3.1. приведена температурная зависимость изменения энергии Гиббса ∆ Gо при образовании углеводородов из простых веществ. Изменение энергии Гиббса при взаимном превращении углеводородов может быть определено для данной температуры как разность ординат точек на соответствующих кривых. Система всегда стремится перейти в состояние, характеризующееся наименьшим значением энергии Гиббса, поэтому из рис. 3.3.1 следует, что при 500 К реакция превращения н-гексана в бензол термодинамически не разрешена (∆ Gо бензола - ∆ Gо н-гексана > 0) и возможна при 900 К (∆ Gо бензола - ∆ Gо н-гексана < 0). Как видно из рис. 3.3.1 при температурах пиролиза термодинамическая стабильность углеводородов разных классов с одинаковым числом углеводородных атомов в молекуле понижается в следующем ряду: арены > алкены> цикланы> алканы. Таким образом, в процессе пиролиза термодинамически более вероятно образование аренов и алкенов. Качественно оценить влияние температуры и давления на термодинамическую вероятность того или иного превращения можно исходя из принципа Ле Шателье. Повышение температуры способствует протеканию эндотермических реакций распада и дегидрирования, повышение давления – протеканию реакций гидрирования, алкилирования, полимеризации, идущих с уменьшением объема.
Рис. 3.3.1. Зависимость изменения энергии Гиббса DGO при образовании углеводородов из простых веществ от температуры: 1 - гексен, 2 - циклогексан, 3 – н-гексан, 4 - бензол. Кинетика процесса. Для осуществления той или иной реакции мало создать условия, обеспечивающие термодинамическую возможность и благоприятное положение равновесия. Необходимо, чтобы реакция протекала с приемлемой для технологических целей скоростью. Энергии активации реакций пиролиза достаточно велики. Они находятся в пределах 200-280 кДж/моль. Следовательно, изменение температуры оказывает значительное влияние на скорость реакций пиролиза. Преобладающим типом первичных превращений углеводородов является их распад (разрыв связей С-С и С-Н, образование кратных связей). Константы скорости реакций распада представляют собой с достаточной степенью приближения функцию количества энергии, которую необходимо затратить для разрыва (диссоциации) определенного типа связи, т.е. являются функцией энергии связи. Анализ значений энергий связей показывает, что при температурах пиролиза с наибольшей скоростью распадаются алканы, значительно медленнее арены (табл. 3.3.1) Алкены и циклоалканы занимают промежуточное положение. Таблица 3.3.1 Усредненные энергии связей
Как известно, влияние давления на скорость газофазных реакций зависит от кинетических порядков в уравнении для скорости реакции по парциальным давлениям реагентов (кинетический порядок – это показатель степени давления данного реагента в кинетическом уравнении). Скорость реакции конденсации описывается уравнением приблизительно второго порядка, тогда как реакции распада – первого порядка по давлению исходных углеводородов. Поэтому понижение давления уменьшает отношение скорости реакции конденсации к скорости реакции распада для каждого углеводорода, участвующего в процессе.
|