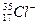ЗАНЯТТЯ №7
Тема: Періодичний закон. Періодична система хімічних елементів. Поняття про періоди і групи. Фізичний зміст періодичного закону Актуальність теми: Періодична система елементів стала ключем до пізнання будови атома. З іншого боку, розкриття структури атома сприяло утвердженню і розвитку періодичного закону. Відповідно до сучасних наукових уявлень про атом основою класифікації елементів і періодичності їх властивостей є заряд атомного ядра. Валентність, електронегативність – це ті властивості атомів, які безпосередньо залежать від будови їх електронних оболонок, і визначають поведінку елементу в хімічних реакціях. Навчальні цілі: Знати: основні поняття і положення атомно-молекулярного вчення, будову ядра атома, будову електронних оболонок атома, розподіл електронів останнього електронного рівня елементу в залежності від номера групи, класифікацію елементів на метали і неметали. Уміти: визначати заряд ядра атома, кількість електронів, протонів і нейтронів, складати електронні формули, визначати валентні електрони, заповнювати електронні оболонки атома залежно від періоду, визначати властивості елементу залежно від його положення в періодичній системі елементів, заповнювати електронні комірки атома залежно від періоду. Самостійна позааудиторна робота ! Написати в робочому зошиті: 1. Заповнити таблицю, вибираючи серед вказаних атомів елементів:
As, K, Br, Te, Sb, Bi, Si, Ne, N, Se, Rb, Ca, He, C, P, Li, І, O, Ba. 2. Написати йони Літію (Li), Алюмінію (Al), Хлору (Cl). Який з елементів: а) віддає електрони; б) забирає електрони. 3. Елемент ІІ групи віддав 2 електрони. Чи завершений у нього електронний рівень? 4. Що спільного у атомів елементів Натрію і Калію? Написати електронні формули вказаних атомів та формули їх вищих оксидів. 6 Дати відповіді на тести: 1. До одного періоду належать елементи з порядковим номером: а) 12 і 20; б) 11 і 18; в) 10 і 14; г) 20 і 30. 2. До однієї групи належать елементи з порядковим номером: а) 9 і 18; б) 9 і 17; в) 8 і 17; г) 8 і 12. 3. Який хімічний елемент утворює вищий оксид R2О? а) Zn; б) Ti; в) Ca; г) К. 4. Лужному металу відповідає порядковий номер: а) №10; б) №11; в) №12; г) №11. 5. Який з цих елементів є галогеном? а) кисень; б) вуглець; в) натрій; г) хлор. 6. Атом якого елементу має на зовнішньому рівні 5 електронів: а) №11; б) №17; в) №25; г) №33. 7. Який з вказаних атомів віддав електрон? а) О-2; б) Cl‾ ; в) Cа+2; г) Не0. 8. Який з вказаних атомів забрав електрон? а) О-2; б) S+6; в) Cа+2; г) Не0. Контрольні питання: 1. Хто і коли відкрив періодичний закон? 2. Формулювання періодичного закону, яке дав Д.І. Менделєєв. 3. Сучасне формулювання періодичного закону. В чому його відмінність? 4. Які принципи лежать в основі періодичної системи? 5. Яка інформація про елемент знаходиться в комірці періодичної системи? 6. Що таке період? Скільки елементів знаходиться в кожному періоді? 7. Як змінюються хімічні властивості елементів а) малих, б) великих періодів? 8. Що таке група? Скільки груп знаходиться в періодичній системі? 9. Що таке підгрупа? Приклади. 10. Які елементи знаходяться в головних (А) а які в побічних (Б) підгрупах? 11. Які елементи відносяться до: лужних, лужноземельних, благородних газів, халькогенів, галогенів? 12. Що таке масове число елемента? 11. Що таке заряд ядра атома елемента? 14. Як залежить будова атомних ядер від номера періоду і номера групи
Самостійна робота на занятті ! Написати в робочому зошиті: 1. Написати йони кальцію (Са), нітрогену (N), феруму (Fe). Який з елементів при цьому: а) віддає електрони; б) забирає електрони. 2. Елемент карбон (С) знаходиться в ІV групі. Скільки електронів він може віддати або забрати в іншого елемента для завершення свого енергетичного рівня? 3. У атомі елементу Кальцію 20 протонів і 20 нейтронів. Який заряд несе йон кальцію з 18 електронами в електронній оболонці? Написати латинський символ цього йона. 4. Вищий оксид елемента ІІІ групи періодичної системи має молекулярну масу 102. Який це елемент? 5. Заповнити пропуски в таблиці:
6. Формула вищого оксиду елементу V групи R2O5. Знайти елемент, якщо масова частка Оксигену в оксиді 56, 34%. 7. Вказати елемент, який належить до VІ групи періодичної системи, якщо відносна молекулярна маса його вищого оксиду становить 80. Відповідь підтвердити розрахунком. 8*. Атом елементу має на 4 електрони більше ніж атом Магнію. Знайти цей елемент і вказати його атомну масу.
|