ЗАНЯТТЯ 10
Тема: Йонний зв’язок, як граничний випадок ковалентного зв’язку. Валентність і ступінь окиснення. Металічний та водневий зв'язок. Актуальність теми: Утворення молекул з атомів спричиняє виділення енергії, оскільки за звичайних умов молекулярний стан є стійкішим, ніж атомний. Вчення про будову атома пояснює механізм утворення молекул, а також природу хімічного зв'язку. Навчальні цілі: Знати: умови утворення хімічного зв'язку, типи хімічного зв'язку, будову хімічних сполук, будову атомів хімічних елементів, розподіл електронів по рівнях, валентність та ступінь окиснення елементів. Уміти: визначати тип хімічного зв'язку в сполуці, показати механізми утворення йонного зв'язку, знаходити ступінь окиснення хімічних елементів.
Самостійна позавдиторна робота 1. Вибрати: а) прості речовини; б) складні неорганічні речовини; в) складні органічні речовини. Пояснити чому ви зробили такий вибір? NH3, N2, СО2, О3, С6Н6, CaSО4, С2Н5ОН, Mg(OH)2, S8, Ba(NO3)2, Cl2, Н3РО4, А12О3, СН3СООН, СН4. 2. На останньому енергетичному рівні елементу знаходиться s2p5 електронів. Визначити групу та написати формулу вищого оксиду RxOy. 3. Дати характеристику елементу № 11 за положенням в періодичній системі. 4. Визначити тип хімічного зв'язку: FeCl3, Со, HF, Cl2, PCl5, O2, Na, NaCl. 5. Визначити ступені окиснення Мангану у таких сполуках: KMnO4, MnO2, K2MnO4, Mn(OH)3, MnCl2, Mn2O3, Mn2O7, MnO. 6. Невідомий метал, що проявляє ступінь окиснення +2, утворює оксид з масовою часткою Оксигену 28, 56%. Визначити невідомий метал. 7*.Зобразити будову електронної оболонки атома Хлору, що перебуває в ступені окиснення -1, 0, +1, +3, +5, +7.
6 Дати відповіді на тести 1. Серед наведених речовин вкажіть сполуку з йонним зв’язком: а) Сl2; б) СО; в) Na2O; г) SiO2. 2. Вказати оксид, в якому ступінь окиснення елемента дорівнює +1: а) SO3; б) SO2; в) K2O; г) CuO. 3. Вказати формулу вищого оксиду для елемента з порядковим номером 7: а) R2O5; б) R2O; в) RO; г) R2O3. 4. Між якими молекулами виникає водневий зв’язок? а) НСl; б) HF; в) H2S; г) СН4. 5*. Вказати, яке з наведених тверджень є НЕвірним: Металевий зв’язок має такі ознаки... а) наявність “електронного” газу; б) у вузлах металічої гратки містяться позитивно заряджені йони металів; в) узагальнені електрони не здатні переміщуватись по кристалу металу; г) відсутність напрямленості і насиченості. Контрольні питання: 1. Як утворюється йонний зв'язок? Пояснити на прикладах. 2. Що таке валентність? 3. Які елементи мають постійну валентність? Навести приклади. 4. Теоретично передбачити постійну або змінну валентність елементу Селен (Se) (заряд ядра Z = 34). Для обгрунтування використати електронну формулу Se. 5. Що таке ступінь окиснення? Як він розраховується? 6. Які елементи мають постійний ступінь окиснення? Навести приклади. 7. Які елементи мають змінний ступінь окиснення? Навести приклади. 8. Що таке металічний зв'язок? Властивості сполук з металічним зв'язком. 9. Водневий зв'язок, його види та біологічне значення. Самостійна робота на занятті 1. Зобразити механізм утворення молекул CCl4 і KBr. 2. Визначити валентність елементів в сполуках: FeCl2, HF, PCl5, SО3, N2О5, MgO, СО2, K2O. 3. Скласти формули вищих оксидів елементів III періоду. 4. Скласти за валентностями молекулярні формули сполук: а) алюмінію Al (III) з киснем, б) фосфору P (V) з киснем, в) заліза Fe (II) з сіркою S (II), г) заліза Fe (III) з киснем, г) карбону С (IV) з киснем, д) кобальту Со (ІІІ) з киснем, е) кремнію Si (IV) з киснем, є) сульфуру S (VI) з киснем. 5. Намалювати структурні формули хлориду фосфору (III) і хлориду фосфору (V). Пояснити змінну валентність фосфору за будовою його атома. Чи будуть, на вашу думку, стійкими сполуки фосфору (III) і фосфору (V) з воднем? 6. Написати електронні та структурні формули і знайти ступені окиснення всіх атомів у сполуках: SiH4, O2, AlCl3, H2S, SO2, SO3, F2O2. 7. Скласти формули речовин: Mg+2O–2; Са+2(РО4)3–; Mg+2(NO2)–; Аl+3(SO4)2–; Сr+3Сl–; N+3H+; Fe+3(OH)–; Pb+4SO42–. 8. Знайти ступінь окиснення атомів в молекулах: NH4OH; NH4H2AsO4, Ba(NO3)2; Fe(NO3)3; H2O2, A12(SO3)3; K2SO4; КМnО4; К2Сг2О7; Н4Р2О7, Na3[Al(OH)6], [Cu(NH3)4]SO4, K4[Fe(CN)6]. 9. Знайти ступінь окиснення атомів в йонах: SO42–, РО43–, NH4+, Fe(OH)2+, Cr2O72–, Р2O74+, НСO3–.
Кожний зі студентів отримує індивідуальні завдання. Контрольна робота по темі: «Електронна будова та періодичний закон» Варіант №1 1. На останньому енергетичному рівні елементу знаходиться s2p5 електронів. Визначити групу і написати формулу вищого оксиду RxOy. 2. Написати електронну формулу останнього енергетичного рівня для атомів: 12Mg, 16S. 3. Дати характеристику елементу № 19 за положенням в періодичній системі. 4. Знайти атомну масу елементу VI групи, якщо молекулярна маса його оксиду (RxOy) дорівнює 127. Який це елемент? 5. Маса металу (Х) 6, 4 г (валентність IV), при його взаємодії з Киснем (О2), отримано 12, 8 г оксиду (ХxOy). Який це елемент? В якому періоді та групі він знаходиться? Написати склад ядра та електронну структуру цього елементу. Варіант №2 1. На останньому енергетичному рівні елементу знаходиться s2p1 електрон. Визначити групу і написати формулу вищого оксиду RxOy. 2. Написати електронні формули для елементів: 6C, 21Sc. 3. Дати характеристику елементу № 14 за положенням в періодичній системі. 4. Знайти атомну масу елементу V групи, якщо молекулярна маса його оксиду (RxOy) дорівнює 108. Який це елемент? 5. Маса металу (Х) 9, 2 г (валентність I), при його взаємодії з Хлором (Сl2), отримано 23, 4 г хлориду (ХxCly). Який це елемент? В якому періоді і групі він знаходиться? Написати склад ядра і електронну структуру цього елементу.
Розділ 4. КІНЕТИКА ХІМІЧНИХ РЕАКЦІЙ План §4.1. Класифікація хімічних реакцій. §4.2. Тепловий ефект реакцій §4.3. Швидкість хімічних реакцій. Фактори, від яких залежить швидкість реакції. §4.4. Рівновага хімічних реакцій. §4.5.Способи зсуву хімічної рівноваги. Закон Ле-Шательє.
§4.1. Класифікація хімічних реакцій ХІМІЧНА РЕАКЦІЯ – це процес перетворення вихідних речовин (реагентів) в кінцеві речовини (продукти реакції).
вихідні речовини кінцеві речовини (реагенти) (продукти реакції)
Ø За зміною якості і кількості речовин хімічні реакції ділятьсяна: 1) РЕАКЦІЇ СПОЛУЧЕННЯ – це реакції, в результаті яких із двох або більше вихідних речовин утворюється один продукт реакції
2) РЕАКЦІЇ РОЗКЛАДУ – це реакції, в результаті яких із однієї вихідної речовини утворюється два або більше продуктів реакції
3) РЕАКЦІЇ ЗАМІЩЕННЯ – це реакції, в результаті яких атоми простої речовини заміщують атоми будь-якого елементу в складній речовині
Такі реакції можливі тоді, коли атоми більш активного елементу витісняють атоми менш активного елементу в складній речовині.
Ряд активності металів:
Цей ряд характеризує хімічні властивості металів: 1. Чим лівіше розташований метал у ряді, тим легше він віддає електрони (ОКИСНЮЄТЬСЯ) – має сильнішу ВІДНОВНУ здатність; і тим важче його йони приєднують назад електрони - слабша ОКИСНА здатність йона в розчині. 2. Кожний метал може витісняти з розчинів солей ті метали, які стоять справа від нього у ряді. Тобто метал віддає електрони і перетворюється на ЙОН, при цьому ВІДНОВЛЮЄ йони інших металів в електронейтральні атоми. Fe0 + Cu+2SO4 = Сu0 + Fe+2 SO4 (атом феруму Fe ® йон феруму Fe+2) 3. Тільки метали, що стоять у ряді зліва від водню (Н), здатні витісняти його з розчинів кислот (наприклад, Zn, Fe, Pb, але не Сu, Hg, Ag). Zn + H2SO4 = H2+ Zn SO4 Сu + H2SO4 ≠ реакція не відбувається 4) РЕАКЦІЇ ОБМІНУ - це реакції, в результаті яких дві складні речовини обмінюються своїми складовими частинами. Такі реакції протікають за умови утворення: 1) осаду (¯), 2) газу (), 3) води.
До реакцій обміну відносяться два види реакцій, важливі для людини:
Ø За зміною енергії хімічні реакції діляться на:
Ø За зміною ступеня окиснення елементів хімічні реакції діляться на:
Окисно-відновні реакції лежать в основі дуже важливих процесів в організмі людини: травлення, дихання, біосинтез та інші.
Ø За напрямом протікання хімічні реакції діляться на:
Велика частина реакцій в організмі людини – це оборотні процеси. §4.2. Тепловий ефект реакцій Формами передачі енергії є теплота і робота. ТЕПЛОТА – це форма передачі енергії, яка здійснюється в системі шляхом безпосереднього контакту мікрочастинок при їх хаотичному русі. ЕКЗОТЕРМІЧНА РЕАКЦІЯ (від латинського " екзо" – назовні) – це реакція, що відбувається з виділенням теплоти (+Q). Реакція єекзотермічною, якщов результаті хімічної реакції надлишок енергії вивільняється у вигляді тепла. Тобто, при утворенні " нових" зв'язків виділяється енергії БІЛЬШЕ, ніж було потрібно для руйнування " старих" зв'язків у вихідних речовинах. Прикладом можуть бути РЕАКЦІЇ ГОРІННЯ. Наприклад, природний газ (метан CH4) згоряє в кисні повітря з виділенням великої кількості теплоти (мал. 4.1а). ЕНДОТЕРМІЧНА РЕАКЦІЯ (від латинського " ендо " – всередину ) – це реакція, що відбувається з поглинанням теплоти (-Q). Такі реакції відбуваються тільки при наданні енергії ззовні. Тобто, на руйнування зв'язків у вихідних речовинах потрібно енергії більше, ніж може виділитися при утворенні " нових" зв'язків. Прикладом є утворення оксиду вуглецю (II) CO і водню H2 з вугілля і води, яке відбувається тільки при нагріванні (мал. 4.1б).
Таким чином, будь-яка хімічна реакція супроводжується виділенням або поглинанням енергії. Частіше за все енергія виділяється або поглинається у вигляді теплоти (рідше - у вигляді світлової або механічної енергії). Цю теплоту можна виміряти. Результат вимірювання виражають в кілоджоулях (кДж) для 1 МОЛЯ реагенту або для 1 моля продукту реакції. Така величина називається ТЕПЛОВИМ ЕФЕКТОМ РЕАКЦІЇ. ТЕПЛОВИЙ ЕФЕКТ ХІМІЧНОЇ РЕАКЦІЇ (Q, кДж) – це кількість теплоти, яка виділяється або поглинається під час хімічної реакції. Наприклад, тепловий ефект реакції згоряння водню в кисні можна виразити будь-яким з двох рівнянь: 2 H2 (газ) + O2 (газ)= 2 H2О (рідина) + 572 кДж або H2 (газ)+ 1/2 O2 (газ)= H2О (рідина) + 286 кДж Якщо процес відбувається при постійному тиску (ІЗОБАРНИЙ ПРОЦЕС), вводиться поняття ЕНТАЛЬПІЇ. ЕНТАЛЬПІЯ (∆ Н - читається " дельтааш") – це різниця між вмістом енергії у вихідних речовинах і кінцевих продуктах реакції. Якщо система виконує роботу, то може відбуватися виділення або поглинання тепла (Δ Q), зміна ентальпії (∆ Н) ∆ Н = -∆ Q. Це значить, що • тепловий ефект хімічної реакції залежить від стану вихідних речовин і продуктів реакції. • якщо в процесі реакції виділяється тепло (+Q), ентальпія системи зменшується (Δ Н < 0): Q = – Δ Н якщо Q > 0, то Δ Н < 0 – процес екзотермічний. Наприклад, горіння вугілля: С + О2 = СО2 + Q (Δ Н < 0). • якщо в процесі реакції поглинається тепло (Δ Q< 0), ентальпія системи збільшується (Δ Н > 0): якщо Q < 0, то Δ Н > 0 – процес ендотермічний. Наприклад, розклад крейди СаСО3 = СаО + СО2 – Q (Δ Н > 0). §4.3. Швидкість хімічних реакцій. Фактори, від яких залежить швидкість реакції КІНЕТИКА – це наука про швидкість і механізми хімічних реакцій. ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ дорівнює зміні концентрації реагуючих речовин за одиницю часу:
ЧИННИКИ, ВІД ЯКИХ ЗАЛЕЖИТЬ ШВИДКІСТЬ – це умови, які змінюють швидкість хімічних реакцій: 1) Природа реагуючих речовин 2) Концентрація реагуючих речовин. 3) Температура. 4) Каталізатори (ферменти, гормони, ензими). 5) Інші чинники. Отже, можна узагальнити від яких чинників залежить швидкість реакції і яка причина впливу кожного чинника.
Таблиця 7.
|


 3NaOH + H3PO4 = Na3PO4 + 3H2O
3NaOH + H3PO4 = Na3PO4 + 3H2O Мал. 4.1а
Мал. 4.1а
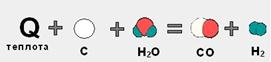 Мал. 4.1б
Мал. 4.1б




