Основные расчетные соотношения. Энергетический баланс отражает закон сохранения энергии, в соответствии с которым в замкнутой системе сумма всех видов энергии постоянна
Энергетический баланс отражает закон сохранения энергии, в соответствии с которым в замкнутой системе сумма всех видов энергии постоянна. Чтобы применить этот закон к ХТП, все внутренние и внешние источники энергии рассматривают как элементы процесса. Это приводит к уравнению теплового баланса в виде: Qуд+ Qто+ Qфп+ Qхр = Qнакопл, (2.1) где Qуд=Qмп, прих - Qмп, расх; Qто=Qто, прих–Qто, расх; Qфп=Qфп, прих – Qфп, расх; Qхр=Qхр, прих – Qхр, расх. Здесь Qмп, прих и Qмп, расх - теплоты материальных потоков на входе и выходе из реактора или малой части реакционного объема; Qто, прих и Qто, расх - теплота, приходящая в реакционный объем и уходящая из него при теплообмене с окружающей средой; Qфп, прих и Qфп, расх - суммы теплот фазовых экзо- и эндотермических переходов; Qхр, прих – Qхр, расх - суммы теплот химических экзо- и эндотермических реакций; Qнакопл - теплота, накопленная реакционным объемом (может быть положительной, отрицательной или равной нулю). Если теплоту представить ее приращением в единице объема за малое время, то получим дифференциальную форму теплового баланса ХТП. В производственных условиях тепловой баланс обычно находят по начальному и конечному результатам: 1. Для вычисления Qмп, прих и Qмп, расх используют формулу Qмп = cр × T × W, (2.2) где cр - теплоемкость при температуре Т; W- расход потока. Расход потока может быть массовый, мольный или объемный в соответствии с размерностью теплоемкости cр (кДж/кг× К, кДж/кмоль× К, кДж/м3× К). Теплоемкость смеси компонентов находят по формуле:
с р, см = где cp, j и Wj - теплоемкость и расход j -го компонента потока. Теплоемкость газов существенно зависит от температуры и определяется по формуле: ср, j = аj + bjТ + cjТ2 + c'jТ-2 + djТ3. (2.4) Коэффициенты этого уравнения для j -го компонента реакционной смеси находят по таблицам (см. Приложение 1). Процедура использования банка данных пакета САТРАПИС для подобных расчетов приведена ниже. При вычислении Qмп что используют также среднюю мольную теплоемкость 2. Вычисление Qто проводят следующим образом: · по изменению температуры охлаждающего агента Qто = c р, х × W х (Tх, н - T х, к), (2.5) где cр, х и W х - теплоемкость и расход, Tх, н и Tх, к - начальная и конечная температуры хладагента, К. Если (T х, н - Tх, к)> 0, Qто заносится в приходную часть баланса, если (Tх, н - T х, к)< 0 - в расходную; · по изменению температуры реакционной смеси от Тн до Тк при Qфп =0 и Qхр =0 Qто = c р, × W (Tк - Tн), (2.6) где c р и W - теплоемкость и расход реакционной смеси; · по параметрам теплообмена через стенку реактора Qто = где l - коэффициент теплопроводности стенки, кДж/с× м× К; d - толщина стенки, м; t - время, с; F - поверхность теплообмена, м2. Здесь kto = 3. Теплоту фазовых переходов Qфп рассчитывают по формуле: Qфп = Sqj, фпWj, фп, (2.8) где qj, фп - теплота фазового перехода, кДж/кмоль; Wj, фп - количество j - го компонента, претерпевшее фазовое превращение, кмоль/с. Значения qj, фп находят по таблицам [2]. Теплота экзотермических фазовых переходов (конденсация, кристаллизация, абсорбции, адсорбция и др.) заносится в приходную часть баланса (Qфп, прих), а эндотермических (парообразование, плавление, растворение, десорбцию) – в расходную (Qфп, расх.). 5. Тепловой эффект ХТП является алгебраической суммой тепловых эффектов всех реакций. Тепловые эффекты отдельных реакций
где Dср =Snj'cpj'-Snj''cpj''; nj - стехиометрические коэффициенты; индекс ' относится к продуктам, а индекс '' - к исходным веществам. Величину cp, j находят по формуле (2.4), а
После преобразований и интегрирования получаем: -qхрT = DНТ0 + Dа(Т1-Т0) + где Dа =Snj'а j'- Snj'' а j''; Db = Snj'b j'- Snj'' b j''; Dc = Snj'c j'- Snj'' c j''; Dd = Snj'd j'- Snj'' d j''. Dc' =Snj'(c j')'- Snj''(c j'')''; T0=298K (2.12) Значения коэффициентов для (2.12), энтальпии для (2.10) и теплового эффекта qхрT берут из таблиц [1, c. 136-137] (см. Приложение 1-3). Чтобы рассчитать тепловой эффект химической реакции для конкретного количества прореагировавшего вещества, содержащегося во всей массе реакционной смеси, используют формулу Qх.рT = qхрT × NА, 0× ХА/nА, (2.13) где nА - стехиометрический коэффициент при компоненте А. При компьютерном расчете можно использовать пакет STR (базу данных пакета САТРАПИС). С помощью программы определяют физико-химические свойства многокомпонентных смесей и тепловой эффект реакций при заданных условиях: · в пункте меню < Расчет физико-химических свойств смесей > выбирают подменю < Расчет свойств свободного потока> (если с данным потоком работали ранее) или < Обновить описание потока> (если данный состав или процесс рассматриваются впервые); · указывают число веществ в системе и из базы данных выбирают необходимые вещества; · задают состав потока и условия проведения процесса; · выбирают желаемую размерность и получают результаты расчета теплофизических параметров - теплоемкость, плотность и др. свойства газовой смеси.
|

 (2.3)
(2.3) (см. Приложение 2).
(см. Приложение 2). × t× F× (Tк - Tх) = kto × F× (Tк - Tх), (2.7)
× t× F× (Tк - Tх) = kto × F× (Tк - Tх), (2.7) при температуре процесса Т в расчете на 1 кмоль ключевого компонента определяют по формуле
при температуре процесса Т в расчете на 1 кмоль ключевого компонента определяют по формуле , (2.9)
, (2.9) - по формуле (2.10):
- по формуле (2.10):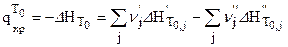 (2.10)
(2.10) (2.11)
(2.11)


