СЛОЖНЫЕ БЕЛКИ
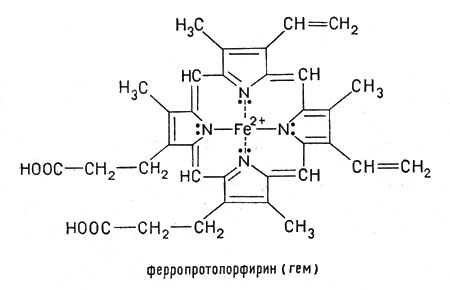
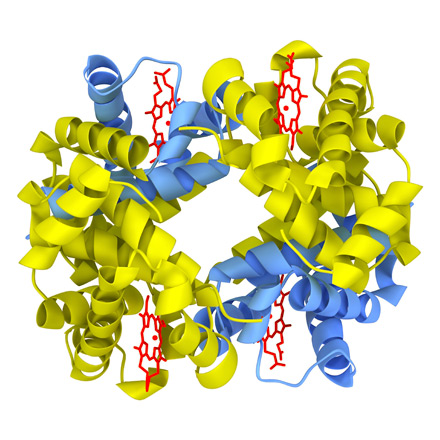
1. Хромопротеины (от греч. chroma - краска) состоят из простого белка и связанного с ним окрашенного небелкового компонента. Различают гемопротеины и флавопротеины. Они участвуют в таких процессах, как дыхание, транспорт кислорода и диоксида углерода, окислительно-восстановительные реакции, свето- и цветовосприятие и др. К группе гемопротеинов относятся гемоглобин, миоглобин, цитохромы, каталаза, пероксидаз. Все они содержат железопорфирины, но различные по составу и структуре белки, и выполняют разнообразные биологические функции. Видовые различия гемоглобина обусловлены глобином. Рассмотрим строение гемоглобина – белка крови. Небелковым компонентом гемоглобина является гем - пигмент, придающий крови красный цвет. Основу его структуры составляет протопорфирин IX (рис. 5). В центре гема расположен атом железа, связанный с двумя атомами азота ковалентно и с двумя другими - координационными связями. Гем «обернут» одной полипептидной цепью. В молекуле гемоглобина взрослого человека НbА (от англ. adult- взрослый) содержатся четыре полипептидные цепи, которые вместе составляют белковую часть молекулы – глобин (рис. 6). Две α -цепи содержат по 141 аминокислотному остатку, две β -цепи - по 146.
В крови взрослого человека присутствуют также гемоглобин НbА2 (2α, 2δ цепи, 2, 5%) и НbA3 (менее 1%, отличается строением b-цепи). Известен фетальный гемоглобин (гемоглобин новорожденных) HbF, состоящий из 2 α - и 2 γ -цепей. Гемоглобин F обладает повышенным сродством к кислороду и позволяет сравнительно малому объёму крови плода выполнять кислородоснабжающие функции более эффективно. Кровь новорожденного содержит до 80% HbF, к концу 1-го года жизни он почти целиком заменяется на НbА. Болезни гемоглобинов (более 200) называют гемоглобинозами. 1. Гемоглобинопатии, в основе которых лежит наследственное изменение структуры какой-либо цепи нормального гемоглобина. В крови человека открыто около 150 различных типов мутантных гемоглобинов. Аномальные гемоглобиныразличаются по физико-химическим свойствам (электрофоретическая подвижность, растворимость, изоэлектрическая точка, сродство к кислороду). Классический пример гемоглобинопатии - серповидно-клеточная анемия, распространенная в странах Южной Америки, Африки и Юго-Восточной Азии. Химический дефект сводится к замене глутаминовой кислоты в 6-м положении с N-конца на валин в β -цепях молекулы гемоглобина HbS. Это результат мутации в молекуле ДНК. У HbS снижены растворимость и сродство к кислороду. Эритроциты в условиях низкого парциального давления кислорода принимают форму серпа. HbS после отдачи кислорода в тканях превращается в плохо растворимую дезоксиформу и выпадает в осадок в виде веретенообразных кристаллов. Они деформируют клетку и приводят к гемолизу. Гетерозиготная форма аномалии протекает бессимптомно или сопровождается легкой гемолитической анемией. У гомозиготных особей уже с первых месяцев жизни развивается тяжелая форма серповидноклеточной анемии. Болезнь протекает остро, и дети часто умирают в раннем возрасте. 2. Талассемии - группа заболеваний с наследственным нарушением синтеза одной из цепей глобина. Различают α - и β -талассемии. Гемоглобинопатия Н - один из вариантов a-талассемии - проявляется гемолитической анемией, выпадением в осадок гемоглобин Н, увеличением селезенки, тяжелыми костными изменениями. 3. Железодефицитные анемии - нарушение синтеза гемоглобина вследствие дефицита железа. Основными причинами являются кровопотери и недостаток богатой гемом пищи - мяса и рыбы.
|