Ln < 0
ln ЗАДАЧА. Определить температурную область самопроизвольного протекания реакции: С (к) + СО2 (г) = 2СО (г) При стандартных состояниях компонентов. Решение. Реакция протекает самопроизвольно при стандартных состояниях компонентов (∆ rH0 и ∆ rS0 не зависят от температуры), если: ∆ rG0Т = ∆ rH 0298 - Т ∆ rS0 298< 0 (172,5 – Т .175,66.10-3) < 0 (размерность!) Т > 982 К Температурный интервал (из справочных данных): С (графит) 298 – 2300 К СО2 (г) 298 – 2500 К СО (г) 298 – 2500 К Þ; Искомая область температур: 982 ÷ 2300 К
ЗАДАЧА Рассчитайте Кр и Кс реакции С(к) + СО2(г) при 298 К и 1000 К. Сделайте вывод о выходе продукта реакции и определите знак энтальпии реакции. Решение: Кр = ∆ r G 0 Т = – RT ln Кр Þ Kp = exp(– ∆G 0 Т / RT)
∆ r G 0298 = 120,15 кДж; ∆ r G 01000 = –3,16 кДж
Кр 298 = exp(–120 · 103 / 8,31· 298) = ехр(–48,5) = 8 × 10–22
Kp 1000 = exp(+3160 / 8,31 · 1000) = ехр(0,38) = 1,46 (обратите внимание на размерность!) Кс = ∆ν = 2-1=1 Изменение числа молей газообразных веществ! · При 298 К: Кр ® 0 Þ в равновесной смеси практически отсутствуют продукты Þ смещение равновесия в сторону исходных веществ
· При 1000 К: Кр > 1 Þ в равновесной смеси начинают преобладать продукты, их выход растет с ↑ Т · с ↑ Т значение Кр увеличивается Þ ∆ r H0 > 0
 ЗАДАЧА ЗАДАЧА
Решение: Пусть ∆ rH 0 и ∆ rS 0 не зависят от температуры Составим систему из двух уравнений с двумя неизвестными (T 1=400 K, T 2=600 K):
∆ r G0Т 2= ∆ r H0298 – T 2∆ r S0298 = - RT 2ln Кр 2
x – 600 y = -8,31.600 ln4 х = ∆ r H 0298 = 52833(Дж) = 52,833 кДж; y = ∆ r S 0298 = 99,575 Дж/К. ln
ЗАДАЧА Определите равновесное давление СО2при Т = 990 К в реакции СаСО3(к) Решение: Кр = р СО2, Считаем, что ∆ r H 0 и ∆ r S 0 не зависят от Т:
∆ r G0Т = ∆ r H 0298 – T ∆ r S 0298= – RT ln Кр
∆ r H 0298 = ∆ f H 0298, СаО + ∆ f H 0298, СО2 – ∆ f H 0298, СаСО3 = 178,1кДж; ∆ r S 0298 = S 0298,CаО+ S 0298,СО2 - S 0298, СаСО3 = 160,5 Дж/К
178,1 · 103 – 990 · 160,5= – 8,31·990ln К р Þ К р = 0,1 Кр = р СО2 / 105 = 0,1 Þ р СО2 = 104 Па ЗАДАЧА Определить равновесный состав системы С(к) + СО2(г) Т = 1000 К Р общ = 2атм nисх, CO2 = 5 моль Решение: Реакция идет при P = const отличным от 1! Kp =exp(- ∆G0Т / RT) Kp 1000 = exp(+3160/8,31 . 1000)= ехр(0,38) = 1, 46
Кр = = Равновесный: n (СО2) = 5 - 1,7 = 3,3 состав: n (СО) = 2×1,7 = 3,4. ЗАДАЧА Определите сравн СО2 и СО для реакции С(к) + СО2(г) Т = 1000 К, V сосудa = 2 л, m исх (СО2) = 44 г, Рассчитайте, на сколько изменится давление в системе при равновесии по сравнению с исходным Решение: Реакция идет при V = const! с СО2 = Таблица материального баланса:
Кс = с СО, равн = 2. 0,0387 = 0,0774 моль/л с СО2, равн = 0,5 - 0,0387 = 0,4613 моль/л Р 0 = сRT = 0,5.0,082•1000 = 41атм Рравн = (0,5 – х + 2 х) RT = 44,173 атм Þ D Р = 3,173атм
ЗАДАЧА Как увеличить выход продуктов реакции С(к) + СО2(г) Решение: Повысить выход продукта СО Þ; сместить равновесие вправо:
· ↑ Т системы, т. к. ∆ r H 0298 > 0 · ↓ Рсистемы, т. к. прямая реакция идет с увеличением
|

 < - 48,5 Þ
< - 48,5 Þ 
 2СО(г)
2СО(г) ; Кс =
; Кс = 
 =
=  = 0,018
= 0,018 2В(г)
Кр = 0,02 при 400 К и Кр =4,00 при 600 К.
Определите ∆ r H 0298, ∆ r S0298 и Кр при 800 К.
2В(г)
Кр = 0,02 при 400 К и Кр =4,00 при 600 К.
Определите ∆ r H 0298, ∆ r S0298 и Кр при 800 К.
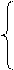 ∆ r G0Т 1= ∆ r H0298 – T 1∆ r S0298 = - RT 1ln Кр 1
∆ r G0Т 1= ∆ r H0298 – T 1∆ r S0298 = - RT 1ln Кр 1  x – 400 y = -8,31.400 ln2.10-2
x – 400 y = -8,31.400 ln2.10-2 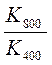 = ln
= ln  =
=  (
(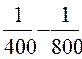 )= 7,95; К 800 = 56,55
)= 7,95; К 800 = 56,55 СаО(к) + СО2(г)
СаО(к) + СО2(г) =
=  =
= = 1,46 Þ х = 1,7 моль.
= 1,46 Þ х = 1,7 моль. =
= 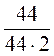 = 0,5 моль/л; Кс, 1000 = 0,018
= 0,5 моль/л; Кс, 1000 = 0,018 =
=  = 0,018 Þ х = 0,0387 моль/л
= 0,018 Þ х = 0,0387 моль/л


