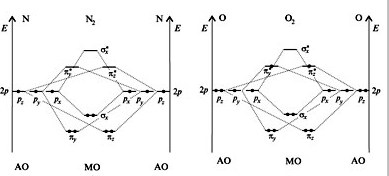
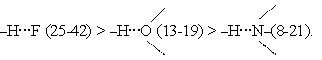Энергетические диаграммы образования молекул N2 и O2. Кратность связи и магнитные свойства.
КРАТНОСТЬ СВЯЗИ - число электронных пар, обобществлённых двумя соседними атомами молекулы в результате ковалентной 2/4467.html"химической связи 16. Ионная связь и её свойства. Строение ионных кристаллов типа CsCl, NaCl, ZnS (сфалерит) и CaF2 (флюорит). Ионная связь — прочная C"химическая связь, образующаяся между атомами с большой разностью (>1,7 по шкале Полинга) C"электроотрицательностей, при которой общая "электронная параполностью переходит к атому с большей электроотрицательностью. св-ва:ненасыщаемость, дальнодействие, ненаправленность. 17. Металлическая связь и её свойства. Кристаллические структуры металлов типа вольфрама, меди и магния. Координационные числа и плотность упаковки атомов. Металлическая связь — C"химическая связь, обусловленная наличием относительно свободных %AD%D%BB%D%B%D%BA%D%82%D%80%D%BE%D %BD"электронов. Характерна как для чистых %C%D%B%D%82%D%B%D%BB%D %BB"металлов, так и их %A%D%BF%D%BB%D%B%D%B "сплавов и B"интерметаллических соединений. Электропроводность и теплопроводность. Эти свойства свидетельствуют о том, что валентные электроны способны свободно перемещаться в пределах кристаллической решетки. Координационное число (в F"химии и F"кристаллографии) — характеристика, которая определяет число ближайших частиц (%98%D%BE%D %BD"ионов или %90%D%82%D%BE%D %BC"атомов) в "молекуле или %A%D%80%D%B%D%81%D%82%D%B%D%BB%D %BB"кристалле. Количество атомов и размер ячейки определяют плотность упаковки атома. Плотность упаковки атома вдоль разных атомных плоскостей внутри кристалла различна. 18. Водородная и меж- и внутримолекулярная связь. Представление о природе, длине и прочности водородных связей. Влияние водородных связей на температуры плавления и кипения веществ (H20, HF, NH3), на прочность волокнистых материалов. Водородная связь — форма %90%D%81%D%81%D%BE%D%86%D%B%D%B%D%86%D%B%D%F_(%D%85%D%B%D%BC%D%B%D% F)"ассоциации между C"электроотрицательным атомом и атомом водорода H, связанным C"ковалентно с другим% C"электроотрицательным атомом. В качестве электроотрицательных атомов могут выступать %90%D%B%D%BE%D %82"N, %A%D%B%D%81%D%BB%D%BE%D%80%D%BE%D%B "O или %A%D%82%D%BE%D %80"F. Водородные связи могут быть"межмолекулярными или "внутримолекулярными. Внутримолекулярная водородная связь является преобладающей только для разбавленных растворов (0 05 М) эфиров. По мере увеличения концентрации возрастают межмолекулярные водородные связи эфиров. Количественное изучение этой связи чрезвычайно затруднено из-за наличия в объеме жидкости единой сетки водородных связей Межмолекулярная водородная связь возникает между молекулами, в состав которых входят водород и сильно электроотрицательный элемент - фтор, кислород, азот, реже хлор и сера. Особенностями водородной связи, по которым её выделяют в отдельный вид, является её не очень высокая прочность %92%D%BE%D%B%D%BE%D%80%D%BE%D%B%D%BD%D%B%D%F_%D%81%D%B%D%F%D%B%D%C", её распространенность и важность, особенно в органических соединениях %92%D%BE%D%B%D%BE%D%80%D%BE%D%B%D%BD%D%B%D%F_%D%81%D%B%D%F%D%B%D%C"], а также некоторые побочные эффекты, связанные с малыми размерами и отсутствием дополнительных электронов у водорода. В настоящее время в рамках "теории молекулярных орбиталей водородная связь рассматривается как частный случай C"ковалентной с делокализацией электронной плотности по цепи атомов и образованием трёхцентровых четырёхэлектронных связей (например, -H•••[F-H•••F]-). Энергия водородной связи возрастает с увеличением электроотрицательности (ЭО) и уменьшением размеров атомов В. Поэтому наиболее прочные водородные связи возникают, когда в качестве атомов В выступают F, О или N. Энергия связи (кДж/моль) возрастает в ряду
Несмотря на высокую ЭО у хлора, водородная связь –Н···Cl– относительно слабая из-за большого размера атома хлора
|