II начало термодинамики. Летучесть (фугитивность f) – давление, формально исправленное так, чтобы при данной температуре и да
3. Оствальд: невозможно построить такую периодически действующую машину (вечный двигатель второго рода), все действия которого сводились бы к производству работы и соответствующему охлаждению источника.
Рисунок. Цикл Карно (а) и термодинамическая схема тепловой машины (б).
Теорема Карно– Клаузиуса:
коэффициент полезного действия машины (КПД) при работе по обратимому циклу не зависит от природы рабочего тела, а определяется только интервалом температур, в котором совершается работа:
.
для элементарного цикла Карно:
для бесконечно малого цикла Карно:
для конечного цикла Карно
или в пределе может быть заменена интегралом по замкнутому контуру:
фундаментальное уравнение термодинамики
в пределе
Совместное уравнение первого и второго начала термодинамики:
В изолированных системах: · всякий самопроизвольный процесс сопровождается возрастанием энтропии, · этот процесс идет до тех пор, пока система не придет в равновесное состояние, при котором S достигает максимального значения, т.е. при равновесии dS=0,
Равновесное состояние является наиболее вероятным, то, следовательно, энтропия может служить мерой вероятности данного процесса. Примеры расчетов изменения энтропии идеального газа в различных процессах.
1. изотермическое расширение (сжатие) от начального состояния (
Для обратимого процесса:
Т.к.
Пример.
Рассчитайте изменение энтропии в процессе изотермического расширения 10 г криптона от объема 0,05 м3 до объема 0,2 м3 при температуре 500 К. Решение. Для решения задачи воспользуемся формулой
2. нагревание (охлаждение) без фазового перехода:
в общем случае:
В случае процесса:
.
3. Изменение энтропии идеального газа одновременном изменении давления (или объема) системы и температуры:
Пример.
Рассчитайте изменение энтропии, происходящее при расширении до 400 см3 и одновременном нагревании до 50 ºС криптона ( Решение.
Ø изотермическое расширение от Ø изохорное нагревание от
Т.е.
4. Изменение энтропии идеального газа при фазовом переходе:
где
Пример.
Рассчитайте изменение энтропии при испарении 0,5 моль метанола ( Решение. Процесс испарения метанола
Для расчетов используем формулу где
Выпишем из справочника необходимые данные:
Следовательно,
5. Изменение энтропии в процессе химической реакции.
Пример. Пользуясь данными таблицы стандартных термодинамических характеристик веществ, определите изменение энтропии химической реакции:
при температурах 400К и 1400К и стандартных исходных давлениях реагентов. Решение. Данные для решения задачи берем из справочника:
Рассмотрим два варианта расчета: Ø Без учета зависимости теплоемкости от температуры:
(коэффициенты не учитываем, т.к. они все равны единице);
Тогда,
Ø С учетом зависимости теплоемкости от температуры:
где
т.е. формула для расчета
после интегрирования получаем:
ПОСТУЛАТ ПЛАНКА
Энтропия является мерой неупорядоченности системы (т.к. процесс разупорядочивания является процессом необратимым – например, легко встряхиванием смешать шарики двух цветов, но никаким встряхиванием нельзя разделить их обратно). Причем, чем больше неупорядоченность, тем больше энтропия, и, наоборот, для правильного кристалла энтропия будет меньше, чем для неправильного кристалла. Так как увеличение температуры увеличивает тепловое (хаотическое) движение частиц, то снижение температуры должно приводить к уменьшению энтропии. Отсюда вытекает, так называемый, Постулат Планка
Его формулировка:
При абсолютном нуле энтропия правильно образованного кристалла любого элемента или соединения в чистом состоянии равна нулю, а при любом другом состоянии вещества его энтропия больше нуля. Следствие: теплоемкость химически однородного кристалла при абсолютном нуле равна нулю.
На основании этого постулата можно рассчитать абсолютную энтропию для вещества при любой температуре, если известны теплоемкости этих веществ от абсолютного нуля до нужной нам температуры, а также тепловые эффекты и температуры всех фазовых переходов (если они происходят в данном температурном интервале):
т.к.
Если в интервале от 0 до Т имеется какой – либо фазовый переход с теплотой перехода lпер., и температурой перехода Тпер., то
где С/р – теплоемкость более высокотемпературной модификации. Если при интересующей нас температуре вещество находится в жидком состоянии, то
Например, для воды зависимость S от Т будет иметь следующий вид. Следует отметить, что и при абсолютном нуле некоторые составляющие энтропии, обуславливаемые спином ядра и изотопным эффектом, не становятся равными нулю, поэтому постулат Планка носит условный характер.
Рис. 1
|




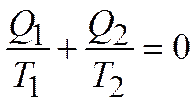 или
или 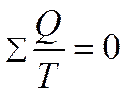
 или
или 

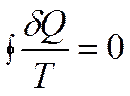
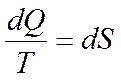 , где
, где 
 – аналитическое уравнение II закона термодинамики
– аналитическое уравнение II закона термодинамики


 –
– ;
; 
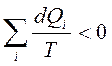 , т.е.
, т.е.  и
и  .
.
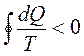


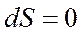






 и
и  .
. ;
;  ) до конечного состояния (
) до конечного состояния (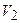 ;
; 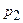 ):
):
 , то
, то  , то
, то  .
. .
. .
. 


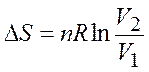
 .
.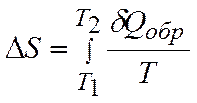 .
.



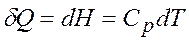
 · Если
· Если 

 ), содержащегося в контейнере объемом 100 см3 при 25 ºС а давлении
), содержащегося в контейнере объемом 100 см3 при 25 ºС а давлении  Па.
Па.
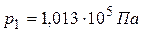
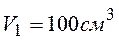 т.е.
т.е. 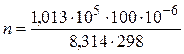



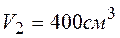
 ;
; до
до  , при этом
, при этом  .
.







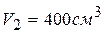
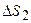
 Þ
Þ  .
.
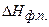 – энтальпия фазового перехода.
– энтальпия фазового перехода. ,
, .
. ,
, .
. ,
, 
 .
.


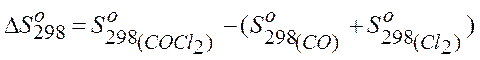


 Дж/К
Дж/К
 Дж/К
Дж/К
 Дж
Дж
 Дж
Дж
 ,
, ,
, ,
,
 :
: ,
,
 Дж/К
Дж/К
 Дж/К
Дж/К
 Дж/К
Дж/К
 Дж/К
Дж/К

 Дж
Дж

 Дж
Дж
 .
.
 ,
,  .
. ,
, .
.



