Вычисления по химическим уравнениям, если одно из исходных веществ содержит примеси.
Основные
расчётные формулы:
m = ν ∙ M
ν = m / M
ν = V / Vm
V = ν ∙ Vm
Vm = 22,4 л/моль
ν - количество вещества
Абсолютно чистого вещества в природе не бывает, поэтому в химических производствах вынуждены использовать исходные вещества, содержащие примеси. Содержание примеси обычно выражают в долях от единицы (или выражают в %). Для вычисления массы основного вещества, содержащегося в смеси, используют формулу 2. 1) 2) 3)m(технич.) = m(осн.в.) + m(прим.) (3) Решение задачи следует начать с расчета массовой доли основного вещества. Далее необходимо определить его массу и количество вещества. Записать уравнение нужной реакции со всеми коэффициентами. По уравнению реакции определить количество вещества Далее рассчитываются масса или объем требуемого вещества. Задача:Какой объем углекислого газа (н. у) выделится при прокаливании 5 кг. известняка, в котором массовая доля некарбонатных примесей равна 20%.
mтех(CaCO3) = 5кг. ω (примесей) =20% Составим схему решения задачи: _________________ Найти:V(CO2)-? mтех(CaCO3) → m (CaCO3) → n(CaCO3) → n(CO2) → V(CO2) ∕ ∕; ↑ M(CaCO3) Vm=22,4 л/моль ω (примесей) → ω(CaCO3) 1) 2)
3)
4)Запишем уравнение реакции и найдем n(CO2): CaCO3 → CaO +CO2 n(CO2)=n(CaCO3) = 40моль. 5)
Ответ: 896 л.CO2. Задача № 2К 200 г 12,25%-ного раствора серной кислоты прилили избыток раствора нитрата бария. Определите массу выпавшего осадка. Решение. 1) Составлено уравнение реакции: H2SO4 + Ba(NO3)2 = BaSO4↓ + 2HNO3 2) Рассчитана масса и количество вещества серной кислоты, содержащейся в растворе: m (H2SO4) = 200 · 0,1225 = 24,5 (г); n (H2SO4) = 25,4: 98 = 0,25 (моль). 3) Определена масса вещества, выпавшего в осадок: по уравнению реакции n (H2SO4) = n (BaSO4) = 0,25 (моль); m (BaSO4)= 0,25 · 233 = 58,25 (г). ответ: 58,25. Задача №3. К 27 г раствора с массовой долей хлорида меди (II) 10 % добавили избыток раствора сульфида натрия. Определите массу выпавшего осадка. Решение. 1) Составлено уравнение реакции: CuCl2 + Na2S = CuS↓ + 2NaCl 2) Рассчитана масса и количество вещества нитрата серебра, содержащегося в растворе: m (CuCl2) = m(p-pа) · ω/100 = 27 · 0,1 = 2,7 (г); n (CuCl2) = m (CuCl2)/ M (CuCl2) = 2,7: 135 = 0,02 (моль). 3) Определена масса вещества, выпавшего в осадок: по уравнению реакции n (CuCl2) = n (CuS) = 0,02 (моль); m (CuS) = n (CuS) · M(CuS) = 0,02 · 96 = 1,92 (г). ответ: 1,92. Задача. 4. Задачи на примеси в исходных веществах. 4-3-1. Обжигом 277 г сульфида цинка, содержащего 30% несульфидных примесей, получен оксид цинка массой ____ г. (число с точностью до целых). Дано: m (образца ZnS) = 277 г ω(примесей) = 30%. Найти: m (ZnO) =? г. Решение: 1. Находим сколько чистого сульфида цинка находится в исходной смеси. ω(ZnS) = 100-30 = 70 (%) или 0.7. m (ZnS) = 277×0.7 = 193.9 (г). 2. Записываем уравнение реакции, присоединяем к уравнению количественные данные и составляем пропорцию. 193.9 г х г 2ZnS + 3О2 = 2ZnO + 2SО2 194 г 162 г 3. Решение пропорции относительно х. х = 193.9×162/194 = 162. Ответ: 162 г.
|

 (1)
(1)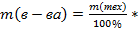 ω(в-ва) (2)
ω(в-ва) (2) Дано: Решениезадачи:
Дано: Решениезадачи:
 100%
100% 80%=4000г.M=40+12+3*16=100
80%=4000г.M=40+12+3*16=100 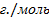
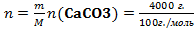 =40 моль
=40 моль
 =896л.
=896л.


