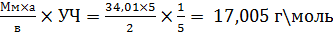Solutio Hydrogenii peroxydi diluta
H2O2 Мм. 34,01 Состав: Пергидроля – 10г Антифебрин – 0,05г (0,5%) натрия бензоат в качестве стабилизатора Воды до 100 мл Получение:- в природе незначительные количества перекиси водорода образуется при электрических разрядах во влажной атмосфере; - в промышленности получают путем электролиза аммония сульфата; В лабораторных условиях – действием серной кислоты на пероксид бария BaO2 + H2SO4 → H2O2 + BaSO4 Описание:бесцветная прозрачная жидкость, без запаха или со слабым своеобразным запахом, слабокислой реакции. Быстро разлагается на свету при нагревании, соприкосновении с окислителями и восстановителями, щелочами, некоторыми металлами, выделяя кислород: 2 H2O2 → 2H2O + O2 Подлинность: к препарату прибавляют H2SO4 разведенной, эфир, раствора K2Cr2O7 и взбалтывают, эфирный слой окрашивается в синий цвет H2O2 + K2Cr2O7 + H2SO4 → H2Cr2O8 + K2SO4 + H2O Чистота: кислотность, сухой остаток (не более 0,005%) Количественное определение: 1. Безындикаторная перманганатометрия – основан на окислении перекиси водорода перманганатом калия: 10мл раствора помещают в мерную колбу на 100 мл и доводят водой до метки, к 10 мл полученного раствора прибавляют 5мл H2SO4 разведенной и титруют 0,1М KMnO4 до устойчивой розовой окраски: 2KMnO4 + 5H2O2+3H2SO4 → 2MnSO4 + K2SO4 + 8H2O + 5O2 f(H2O2) = ½; УЧ = 1\5 Э = Т=
|