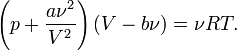Реальные газы. Отличие реальных газов от идеального. Уравнение Ван-Дер-Ваальса.
Реальный газ — газ, который не описывается уравнением состояния идеального газа Клапейрона — Менделеева. Зависимости между его параметрами показывают, что молекулы в реальном газе взаимодействуют между собой и занимают определенный объём. Состояние реального газа часто на практике описывается обобщённым уравнением Менделеева — Клапейрона:
где p — давление; V - объем T — температура; Zr = Zr (p,T) — коэффициент сжимаемости газа; m - масса; М — молярная масса; R — газовая постоянная. Отличие реальных газов от идеального: Молекулы идеального газа не сталкиваются друг с другом, а в реальном газе они движутся сталкиваясь. Идеальный газ поэтому легче рассчитывать. Но в реале идеального газа не существует.
Уравнение Ван-дер-Ваальса — уравнение, связывающее основные термодинамические величины в модели газа Ван-дер-Ваальса. Для более точного описания поведения реальных газов при низких температурах была создана модель газа Ван-дер-Ваальса, учитывающая силы межмолекулярного взаимодействия. В этой модели внутренняя энергия Для одного моля газа Ван-дер-Ваальса оно имеет вид:
где · · · · Видно, что это уравнение фактически является уравнением состояния идеального газа с двумя поправками. Поправка Для
где ·
|


 становится функцией не только температуры, но и объёма.
становится функцией не только температуры, но и объёма.
 — давление,
— давление, — молярный объём,
— молярный объём, — абсолютная температура,
— абсолютная температура, — универсальная газовая постоянная.
— универсальная газовая постоянная. учитывает силы притяжения между молекулами (давление на стенку уменьшается, так как есть силы, втягивающие молекулы приграничного слоя внутрь), поправка
учитывает силы притяжения между молекулами (давление на стенку уменьшается, так как есть силы, втягивающие молекулы приграничного слоя внутрь), поправка  — объем молекул газа.
— объем молекул газа. молей газа Ван-дер-Ваальса уравнение состояния выглядит так:
молей газа Ван-дер-Ваальса уравнение состояния выглядит так: