Адиобатный)
Процесс, при котором отсутствует теплообмен между системой и окружающей средой, называется адиабатным, при этом количество теплоты в системе остается постоянными (Q=const). В реальной жизни адиабатных процессов не существует поскольку полностью изолировать систему от окружающей среды не возможно. Однако часто происходят процессы при которых теплообменном с окружающей средой очень мал, например быстрое сжатие газа в сосуде поршнем, когда тепло не успевает отводится за счет нагрева поршня и сосуда.
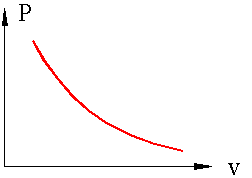
9(). В изохорном процессе (V = const) газ работы не совершает, A = 0. Следовательно, Q = ΔU = U(T2) – U(T1). Здесь U(T1) и U(T2) – внутренние энергии газа в начальном и конечном состояниях. Внутренняя энергия идеального газа зависит только от температуры (закон Джоуля). При изохорном нагревании тепло поглощается газом (Q > 0), и его внутренняя энергия увеличивается. При охлаждении тепло отдается внешним телам (Q < 0). В изобарном процессе (p = const) работа, совершаемая газом, выражается соотношением A = p(V2 – V1) = pΔV. Первый закон термодинамики для изобарного процесса дает: Q = U(T2) – U(T1) + p(V2 – V1) = ΔU + pΔV. При изобарном расширении Q > 0 – тепло поглощается газом, и газ совершает положительную работу. При изобарном сжатии Q < 0 – тепло отдается внешним телам. В этом случае A < 0. Температура газа при изобарном сжатии уменьшается, T2 < T1; внутренняя энергия убывает, ΔU < 0. В изотермическом процессе температура газа не изменяется, следовательно, не изменяется и внутренняя энергия газа, ΔU = 0. Первый закон термодинамики для изотермического процесса выражается соотношением Q = A. В адиабатическом процессе Q = 0; поэтому первый закон термодинамики принимает вид A = –ΔU,то есть газ совершает работу за счет убыли его внутренней энергии. На плоскости (p, V) процесс адиабатического расширения (или сжатия) газа изображается кривой, которая называется адиабатой. При адиабатическом расширении газ совершает положительную работу (A > 0); поэтому его внутренняя энергия уменьшается (ΔU < 0). Это приводит к понижению температуры газа. Вследствие этого давление газа при адиабатическом расширении убывает быстрее, чем при изотермическом расширении (рис. 3.9.2).
|