Закон о растворимости компонентов газовой смеси
Дальтон) Закон о суммарном давлении смеси газов
Давление смеси химически не взаимодействующих идеальных газов равно сумме парциальных давлений.

При постоянной температуре растворимость в данной жидкости каждого из компонентов газовой смеси, находящейся над жидкостью, пропорциональна их парциальному давлению.
4(масс объем моль доли). Массовая доля — отношение массы растворённого вещества к массе раствора. Массовая доля измеряется в долях единицы или в процентах. где: m1 — масса растворённого вещества, г; m — общая масса раствора, г. Объёмная доля — отношение объёма растворённого вещества к объёму раствора. Объёмная доля измеряется в долях единицы или в процентах. где: V1 — объём растворённого вещества, л; V — общий объём раствора, л. Мольная (молярная) доля вещества — концентрация, выраженная отношением числа молей вещества к общему числу молей всех веществ, имеющихся в растворе. Где · 5.(клайперона-менделеева) 6(теплоемкость). Для вычисления количества теплоты, получаемой или отдаваемой системой при переходе из одного состояния в другое, используется понятие теплоемкости. Это одна из важнейших характеристик вещества. Различают молярную и удельную теплоемкости. Молярной теплоемкостью называют количество тепла, которое необходимо сообщить одному молю, вещества, чтобы повысить его температуру на 1К:
Удельной теплоемкостью называют количество тепла, которое нужно передать 1 кг вещества, чтобы повысить его температуру на 1К:
В последних формулах
где 7(процессы). Пусть, для примера, происходит нагрев газа в сосуде, возможны два случая: если поршень зафиксирован и объем не меняется, то произойдет повышение давления в сосуде. Такой процесс называется изохорным (v=const), идущий при постоянном объеме.
eсли поршень свободен то нагреваемый газ будет расширятся при постоянном давлении такой процесс называется изобарным (P=const), идущим при постоянном давлении.;
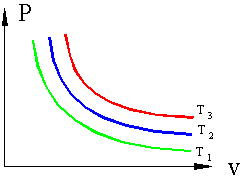
Если, перемещая поршень, изменять объем газа в сосуде то, температура газа тоже будет изменяться, однако можно охлаждая сосуд при сжатии газа и нагревая при расширении можно достичь того, что температура будет постоянной при изменениях объема и давления, такой процесс называется изотермическим (Т=const).
|


 ,
, ,
,
 — мольная доля вещества B в растворе
— мольная доля вещества B в растворе  — количество вещества B, содержащееся в растворе (измеряется в молях)
— количество вещества B, содержащееся в растворе (измеряется в молях)  — сумма количества вещества всех компонентов раствора (измеряется в молях)
— сумма количества вещества всех компонентов раствора (измеряется в молях) где где
где где 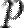 — давление,
— давление,  — молярный объём,
— молярный объём,  — универсальная газовая постоянная
— универсальная газовая постоянная  — абсолютная температура,К.
— абсолютная температура,К.  — масса,
— масса,  — молярная масса, уравнение состояния можно записать: Эта форма записи носит имя уравнения (закона) Менделеева — Клапейрона.
— молярная масса, уравнение состояния можно записать: Эта форма записи носит имя уравнения (закона) Менделеева — Клапейрона.

 – элементарное количество тепла, переданное веществу,
– элементарное количество тепла, переданное веществу,  – изменение его температуры, вызванное этим теплом,
– изменение его температуры, вызванное этим теплом,  и
и  – число молей и масса вещества соответственно.Из формул (4.4.1–4.4.2) нетрудно получить связь между молярной и удельной теплоемкостями:
– число молей и масса вещества соответственно.Из формул (4.4.1–4.4.2) нетрудно получить связь между молярной и удельной теплоемкостями:
 – молярная масса. В дальнейшем, в основном, будем использовать молярную теплоемкость, которую будем называть просто теплоемкостью.
– молярная масса. В дальнейшем, в основном, будем использовать молярную теплоемкость, которую будем называть просто теплоемкостью.