Основные компоненты ремоделирования
Ишемия – это уменьшение кровонаполнения органа или ткани. Причины: · физические: механическая травма (вызывает спазм сосудов), температурные воздействия (холодовое воздействие способствует сокращению мелких артерий кожи). · химические: воздействие кислот, щелочей, прием некоторых ЛС (адреналин, норадреналин, вазопрессин). · психогенные воздействия · тромбозы, эмболии и тд. Исходы: · Инфаркт, гангрена · Восстановление кровотока Сердечная недостаточность- неспособность сердца выполнять насосную функцию вследствие существенного снижения сократительной способности миокарда, а также поражения клапанов сердца или пороков развития системы кровообращения. Как и при острой, так и при хронической сердечной недостаточности все эндогенные механизмы компенсации гемодинамических нарушений можно подразделить на интракардиальные:компенсаторная гиперфункция сердца (механизм Франка-Старлинга, гомеометрическая гиперфункция), гипертрофия миокарда и экстракардиальные:разгрузочные рефлексы Бейнбриджа, Парина, Китаева, активация выделительной функции почек, депонирование крови в печени и селезенке, потоотделение, испарение воды со стенок легочных альвеол, активация эритропоэза и др. Такое деление в некоторой степени условно, поскольку реализация как интра-, так и экстракардиальных механизмов находится под контролем нейрогуморальных регуляторных систем. Компенсаторная гиперфункция сердца выступает как важный фактор компенсации при пороках сердца, артериальной гипертензии, анемии, гипертонии малого круга и других заболеваниях. В отличие от физиологической гиперфункции она является длительной и, что существенно, непрерывной. Несмотря на непрерывность, компенсаторная гиперфункция сердца может сохраняться в течение многих лет без явных признаков декомпенсации насосной функции сердца. Увеличение внешней работы сердца, связанное с подъемом давления в аорте (гомеометрическая гиперфункция), приводит к более выраженному возрастанию потребности миокарда в кислороде, чем перегрузка миокарда, вызванная повышением объема циркулирующей крови (гетерометрическая гиперфункция). Иными словами, для осуществления работы в условиях нагрузки давлением мышца сердца использует гораздо больше энергии, чем для выполнения той же работы, связанной с нагрузкой объемом, а следовательно, при стойкой артериальной гипертензии гипертрофия сердца развивается быстрее, чем при увеличении объема циркулирующей крови. Например, при физической работе, высотной гипоксии, всех видах клапанной недостаточности, артериовенозных фистулах, анемии гиперфункция миокарда обеспечивается за счет увеличения минутного объема сердца. При этом систолическое напряжение миокарда и давление в желудочках возрастают незначительно, и гипертрофия развивается медленно. В то же время при гипертонической болезни, гипертензии малого круга, стенозах клапанных отверстий развитие гиперфункции связано с повышением напряжения миокарда при незначительно измененной амплитуде сокращений. В этом случае гипертрофия прогрессирует достаточно быстро. Гипертрофия миокарда - это увеличение массы сердца за счет увеличения размеров кардиомиоцитов. Существуют три стадии компенсаторной гипертрофии сердца. Первая, аварийная, стадия характеризуется, прежде всего, увеличением интенсивности функционирования структур миокарда и, по сути, представляет собой компенсаторную гиперфункцию еще не гипертрофированного сердца. Интенсивность функционирования структур - это механическая работа, приходящаяся на единицу массы миокарда. Увеличение интенсивности функционирования структур закономерно влечет за собой одновременную активацию энергообразования, синтеза нуклеиновых кислот и белка. Указанная активация синтеза белка происходит таким образом, что вначале увеличивается масса энергообразующих структур (митохондрий), а затем - масса функционирующих структур (миофибрилл). В целом увеличение массы миокарда приводит к тому, что интенсивность функционирования структур постепенно возвращается к нормальному уровню. Вторая стадия - стадия завершившейся гипертрофии - характеризуется нормальной интенсивностью функционирования структур миокарда и соответственно нормальным уровнем энергообразования и синтеза нуклеиновых кислот и белков в ткани сердечной мышцы. При этом потребление кислорода на единицу массы миокарда остается в границах нормы, а потребление кислорода сердечной мышцей в целом увеличено пропорционально возрастанию массы сердца. Увеличение массы миокарда в условиях хронической сердечной недостаточности происходит за счет активации синтеза нуклеиновых кислот и белков. Пусковой механизм этой активации изучен недостаточно. Считается, что определяющую роль здесь играет усиление трофического влияния симпатоадреналовой системы. Эта стадия процесса совпадает с длительным периодом клинической компенсации. Содержание АТФ и гликогена в кардиомиоцитах также находится при этом в пределах нормы. Подобные обстоятельства придают относительную устойчивость гиперфункции, но вместе с тем не предотвращают исподволь развивающихся в данной стадии нарушений обмена и структуры миокарда. Наиболее ранними признаками таких нарушений являются значительное увеличение концентрации лактата в миокарде, а также умеренно выраженный кардиосклероз. Третья стадия прогрессирующего кардиосклероза и декомпенсации характеризуется нарушением синтеза белков и нуклеиновых кислот в миокарде. В результате нарушения синтеза РНК, ДНК и белка в кардиомиоцитах наблюдается относительное уменьшение массы митохондрий, что ведет к торможению синтеза АТФ на единицу массы ткани, снижению насосной функции сердца и прогрессированию хронической сердечной недостаточности. Ситуация усугубляется развитием дистрофических и склеротических процессов, что способствует появлению признаков декомпенсации и тотальной сердечной недостаточности, завершающейся гибелью пациента. Компенсаторная гиперфункция, гипертрофия и последующая декомпенсация сердца - это звенья единого процесса. Механизм декомпенсации гипертрофированного миокарда включает следующие звенья: 1. Процесс гипертрофии не распространяется на коронарные сосуды, поэтому число капилляров на единицу объема миокарда в гипертрофированном сердце уменьшается (рис. 15-11). Следовательно, кровоснабжение гипертрофированной сердечной мышцы оказывается недостаточным для выполнения механической работы. 2. Вследствие увеличения объема гипертрофированных мышечных волокон уменьшается удельная поверхность клеток, в связи с
этим ухудшаются условия для поступления в клетки питательных веществ и выделения из кардиомиоцитов продуктов метаболизма. 3. В гипертрофированном сердце нарушается соотношение между объемами внутриклеточных структур. Так, увеличение массы митохондрий и саркоплазматического ретикулума (СПР) отстает от увеличения размеров миофибрилл, что способствует ухудшению энергоснабжения кардиомиоцитов и сопровождается нарушением аккумуляции Са2+ в СПР. Возникает Са2+-перегрузка кардиомиоцитов, что обеспечивает формирование контрактуры сердца и способствует уменьшению ударного объема. Кроме того, Са2+-перегрузка клеток миокарда повышает вероятность возникновения аритмий. 4. Проводящая система сердца и вегетативные нервные волокна, иннервирующие миокард, не подвергаются гипертрофии, что также способствует возникновению дисфункции гипертрофированного сердца. 5. Активируется апоптоз отдельных кардиомиоцитов, что способствует постепенному замещению мышечных волокон соединительной тканью (кардиосклероз). В конечном итоге гипертрофия утрачивает приспособительное значение и перестает быть полезной для организма. Ослабление сократительной способности гипертрофированного сердца происходит тем скорее, чем сильнее выражены гипертрофия и морфологические изменения в миокарде.
Ремоделирование сердца – это его структурно-геометрические изменения, возникающие под действием патологического фактора и приводящие физиологическую и анатомическую норму к патологии. Основные геометрические типы ремоделирования левого желудочка (ЛЖ) связаны с условиями, в которых они формируются. Перегрузка давлением (стеноз аортального клапана, артериальная гипертензия) приводит к увеличению числа саркомеров и толщины кардиомиоцитов, толщины стенок и формированию концентрического типа геометрии ЛЖ. Объемная перегрузка (клапанная регургитация) вызывает увеличение длины кардиомиоцитов, уменьшение толщины стенок, увеличение его объема и формирование эксцентрического типа геометрии ЛЖ. Основные компоненты ремоделирования Кардиомиоциты. Высокодифференцированные специализированные клетки, вследствие чего у них утрачена способность к делению. В ответ на возрастающую нагрузку при ИМ, АГ, клапанной патологии кардиомиоциты гипертрофируются, в них повышается синтез белка и продукция саркоплазматических сократительных единиц. Пусковыми стимулами гипертрофии являются норадреналин, ангиотензин II, эндотелин, локальные пептиды, стимулирующие рост клеток (инсулиноподобный фактор роста I, кардиотропин I, фактор роста фибробластов), и физические факторы, вызывающие растяжение кардиомиоцитов (повышенная пред- и постнагрузка, повышенное напряжение стенки сердца). Взаимодействуя со специфическими рецепторами на мембране кардиомиоцитов, эти стимулы запускают каскад внутриклеточных сигнальных цепочек. В результате активируются гены раннего ответа (так называемые протоонкогены), ответственные за синтез малых регуляторных протеинов, контролирующих транскрипцию других генов. За этим следует реэкспрессия фетальной генной программы, которая (в моделях на животных) включает индукцию синтеза сократительных белков и неконтрактильных протеинов, таких как предсердный натрийуретический фактор и β2-Na/K АТФ-аза, которые обычно определяются только в фетальном периоде, когда превалирует глобальная клеточная гиперплазия. Подобную реверсию к фетальному геному можно наблюдать во взрослых клетках человека, способных к делению (реэкспрессия α-фетопротеина в поврежденных гепатоцитах при инфекционном гепатите). В то время как другие клетки способны делиться в ответ на молекулярные сигналы, вызванные воздействием неблагоприятных факторов, миоциты, остановленные в G0-фазе клеточного цикла, способны ответить только гипертрофией. Роль пролиферации фибробластов. Как фибробласты, так и эндотелиальные клетки активируются в ответ на ишемическое повреждение. В результате стимуляции фибробластов повышается синтез коллагена, что приводит к фиброзу как инфарцированных, так и неинфарцированных участков миокарда, увеличению «жесткости» миокарда с возникновением диастолической дисфункции, ухудшающей возможность сердца увеличивать выброс. Роль деградации коллагена. Миокард состоит из кардиомиоцитов, связанных и поддерживаемых соединительнотканной сетью, образованной в основном фибриллярным коллагеном, продуцируемым и разрушаемым интерстициальными фибробластами. Некроз клеток в результате ИМ инициирует воспалительную реакцию с лейкоцитарной инфильтрацией и высвобождением протеолитических ферментов, в частности матриксных металлопротеиназ (ММП), которые играют важную роль в последующей деградации коллагена и экспансии инфаркта. Распад коллагена преобладает над его образованием вплоть до 14-го дня с момента ИМ. На протяжении этого периода концентрация ММП-1 остается повышенной. Затем начинает превалировать активность тканевого ингибитора ММП-1, и процесс смещается в сторону инфильтрации фибробластами, отложения коллагена и формирования рубца. В течение ранней литической фазы инфарцированные сегменты уязвимы к изменениям внутрижелудочкового давления и на его повышение отвечают удлинением и истончением. Зона инфаркта, таким образом, расширяется, т.е. происходит экспансия инфаркта. Гистологически истончение стенки происходит в результате скольжения (slippage) мышечных волокон друг относительно друга за счет ослабления связей между миоцитами (в результате деградации коллагенового матрикса) и снижения плотности расположения миоцитов в инфарктной зоне. Некоторые авторы включают в этот гистопатологический процесс не только соскальзывание, но и растяжение клеток, разрыв миоцитов, уменьшение межклеточного пространства
|

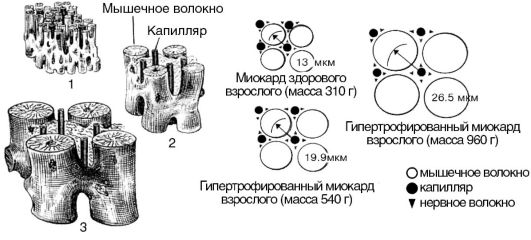 Рис. 5-11. Гипертрофия миокарда: 1 - миокард здорового взрослого; 2 - гипертрофированный миокард взрослого (масса 540 г); 3 - гипертрофированный миокард взрослого (масса 960 г)
Рис. 5-11. Гипертрофия миокарда: 1 - миокард здорового взрослого; 2 - гипертрофированный миокард взрослого (масса 540 г); 3 - гипертрофированный миокард взрослого (масса 960 г)


