Зависимость полноты реакции от температуры, давления, концентрации едкого натра и содержания алюминия в сплавах ФСА
На рисунке 3.9 приведен график изменения давления в кинетическом реакторе в зависимости от числа опытов, проведенные в одинаковых условиях.
Введена гипотеза, что изменение давления в зависимости от N – испытаний подчиняются закону равномерного распределения вероятностей на участке N (1 - 7).
F′ (x) = f (x) (3.6)
f (x) = с, при а < х < b,
следовательно,
где с = 0,076; b – a = 13. Из последнего равенства следует, что интервал (α, β), на котором имеет место равномерное распределение, обязательно конечен. Определение вероятности того, что случайная величина х примет значение, заключенное в интервале N (1 - 7), составляет
Р (α < х < β) = (β – α)/(b – a), (3.7) Р (α < х < β) = 0,46.
Математическое ожидание дискретной случайной величины для независимых факторов носит случайный характер [92, 93]
где хк – дискретная случайная величина, рк – вероятность значений. М (х1) = 396,92; М (х2) = 42,9; М (х3) = 80,67; М (х4) = 34,5. Математическое ожидание квадрата случайной величины [93]
М (х21) = 48834,19; М (х22) = 570,82; М (х23) = 2016,87; М (х24) = 368,97. Дисперсия [92, 93]
D [ x ] = M [ x 2] – M [ x ], (3.10)
D (х1) = 48437,27; D (х2) = 527,9; D (х3) = 1936,2; D (х4) = 334,46. Сумма дисперсий составляет ∑ D2i = 2350308547. Проверка однородности дисперсий производится по критерию Кохрена [93]
Gmax = 0,9982 < G Т = 0,9985 – следовательно дисперсии однородны; где G Т (N, m – 1) – табличное значение критерия Кохрена при уровне значимости Дисперсия воспроизводимости [93]
D2відтв = 3,62. Для дисперсии воспроизводимости значения чисел степеней свободы определяются по формулам [93]
f 1 = N ·(m – 1), (3.13) где m = 3 – количество повторяемых опытов; f 1 = 14.
3.5.1 Оценка значимости коэффициентов регрессии
Среднее квадратичное отклонение j -го коэффициента [93]
Определение коэффициентов регрессии [93]
Свободный член уравнения регрессии определяется по зависимости [93]
b 0 = 5,27; b 1 = 0,89; b 2 = 0,07; b 3 = – 0,3; b 4 = 0,046. Оценка значимости коэффициентов производится по критерию Стьюдента [93]
t 1 = 9,5; t 2 = 1,93; t 3 = 5,21; t 4 = 0,36. Табулированное значение критерия Стьюдента для уровня значимости q = 0,05 и числа степеней свободы f = 14 равно tq (f) = 2,14 [95]. После отсева незначимых коэффициентов, для которых t -отношение меньше табулированного, получено уравнение регрессии в безразмерном виде
X 5 = 5,27 + 0,89 X1 – 0,3 X3. (3.18)
В данное уравнение введены члены учитывающие процентное содержание алюминия в сплавах ФСА и температуру реакции. Определены коэффициенты математической регрессии процесса вытеснения водорода из воды (рис. 3.10).
Рис. 3.10. Зависимость полноты реакции выделения водорода от температуры и процентного содержания алюминия в сплавах ФСА
Для проверки адекватности полученного уравнения, определяем остаточную дисперсию и критерий Фишера [93]
D2ост = 15,204; l = 2 – число связей. Критерий Фишера [92, 93]
F = D2ост/D2воспр, (3.20)
F = 4,2 – соответственно в 4,2 раза уменьшилось рассеяние относительно полученного уравнения регрессии по сравнению с рассеянием относительно среднего. Табулированное значение критерия Фишера для выбранного уровня значимости р = 0,05 и чисел степеней свободы f 1 = N – 1 = 6 и f 2 = N – l = 5 равно 4,39 [95]; F < Fp (f 1, f 2) и следовательно, полученное уравнение адекватно эксперименту. В найденных оптимальных условиях были поставлены контрольные опыты. При увеличении температуры выше 130 ºС и содержании алюминия в сплаве на уровне 25 - 30 % полнота реакции достигает своего максимума. На основании проведенных статистических расчетов установлено, что влияние изменения концентрации щелочи от 10 до 13,3 % и давления на процесс выделения водорода незначительны.
3.6 Выводы по разделу
Таким образом, в условиях проведенных экспериментов выявлены следующие общие закономерности: 1. Кристаллические сплавы ФС, имеющие в своем составе барий и кальций, активнее сплавов ФСА 15, ФСА 30, ФСА 30 Мн1, ФСА 32. 2. Наибольшей скоростью и полнотой реакции обладают сплавы на основе алюминия АВ 86 и А-98КаМг. 3. Снижение концентрации щелочи с 13,3 до 10 % для сплавов ФС 90 Ба4 и ФС 75 Ба1 позволяет повысить полноту реакции на 12 - 15 % по сравнению со сплавами ФС и ФСА. 4. Использование сплавов с добавками бария дает возможность снизить расход едкого натра примерно на 10 - 15 %. 5. Количество алюминия в сплавах ФСА, при получении водорода в баллонных реакторах, не должно превышать 25 - 30 %. 6. При производстве водорода в реакторах, работающих при атмосферном давлении и температуре до 100 ºС, присутствие щелочноземельных металлов в сплавах нежелательно. 7. Скорость выделения водорода возрастает в 1,5 раза по мере измельчения зерен сплавов от (0,5 - 1,5)∙10–3 м до (0,1 - 0,5)∙10–3 м. 8. В результате статистической обработки получено уравнение регрессии, которое адекватно описывает экспериментальные данные и может служить для управления и регулирования процессом получения водорода из воды с использованием сплавов ФСА с содержанием алюминия не более 30 %. Определены основные параметры процесса. В рассмотренных ранее исследованиях с более дешевыми сплавами, полученными из неорганической части низкокалорийных углей ФСА 11 и ФСА 16 [5] процентное содержание кальция составляет 3,6 - 4,0 и магния 0,15 - 0,22. Поэтому дальнейшие исследования сплавов ФСА из отходов углей имеют большую перспективу. Приведенные материалы свидетельствуют о выполнении поставленных задач работы в области разработки технологии получения водорода из воды с помощью сплавов ФСА и ФС с добавками щелочноземельных металлов, и сплавов на основе магния и алюминия. Усовершенствован метод генерирования водорода с использованием сплавов, применение которых экономически обосновано. Определены кинетические характеристики реакций выбранных сплавов и обобщены опытные данные уравнением Ерофеева, с учетом топохимических явлений.
РАЗДЕЛ 2 ТЕПЛОМАССООБМЕН ПРИ ВЗАИМОДЕЙСТВИИ ФЕРРОСИЛИЦИЯ И АЛЮМИНИЕВОГО СПЛАВА С ВОДОЙ
2.1 Методика ведения экспериментов
Для описания явления во всей полноте приходится прибегать как к методам термодинамики, так и к смежным дисциплинам, трактующим процесс с точки кинетики. В данном разделе ставится задача выявить роль тепломассообмена в ходе химических и физических превращений сплавов в оксиды. Опыты по изучению тепломассообмена проведены в стеклянном сосуде и металлическом реакторе (см. раздел 3.4). На данном этапе исследовалась интенсивность теплоотдачи от кубика сплава ферросилиция ФС 90 Ба4 и частиц сплава А-98КаМг к циркулирующему потоку.
Контакт между термопарой и телом кубика контролируют тестером. В качестве вторичного прибора используют потенциометр КСП-4. Одновременно с записью температуры среды фиксируют температуру центра образца. Измерение температуры поверхности образца выполняют термопа- рой со щупом при проведении реакции в открытом сосуде. Оценку инерционности системы проводят следующим образом: в открытый сосуд с кипящей водой погружают спай термопары и начинают отсчет времени. Прибор отображает повышение температуры до 93 °С за 5 с, через 60 - 90 с устанавливается температура 99 °С. При погружении спая термопары в сосуд с маслом, нагретом до 180 °С, прибор через 5 с фиксирует 115 °С, через 55 с – 165 °С и через 180 с устанавливается температура 180 °С. Расчет стехиометрических (теоретических) температур дан в приложении А.
2.2 Результаты исследования тепломассообмена
Опытные данные по взаимодействию образцов сплава ФС 90 Ба4 и сплава на основе алюминия А-98КаМг с водным раствором едкого натра представлены в таблице 4.1 и на рисунках 4.2 - 4.7.
Таблица 4.1 Зависимость скорости выделения водорода от температуры при взаимодействии сплава ФС 90 Ба4 с 13,3 %-ным раствором NaOH (кинетический реактор Vp = 1,13∙10–3 м3 )
Примечание: 1) – NaOH 10 %-ной конц.; 2) – А-98КаМг с 10 % NaOH; 3) – А-98КаМг с 13,3 % NaOH.
Рисунок 4.2. Зависимость скорости выделения водорода от времени при различной температуре для реакции сплава ФС 90 Ба4 с водным раствором едкого натра (кинетический реактор): 1-100 °С (10 % NaOH); 2-103 °С (13,3 % NaOH); 3-128 °С (10 % NaOH); 4-130 °С (13,3 % NaOH); 5-137 °С (13,3 % NaOH).
Давление в реакторе не превышает 0,93 МПа. Максимальная скорость выделения водорода при этом составила Wmax = 1,08∙10–3 м3/(кг∙с) или Wmax = 0,35 м3/(м2∙с) – см. табл. 4.1.
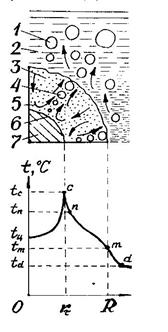
Установлено, что температура внешней поверхности гидроксидного слоя в местах газообразования (tm) выше температуры среды (td) на 2,3 - 3,1 °С.
3,1 - 5,3 °С [97] (рис. 4.4). Приближение фронта реакции к спаю термопары, находящегося в центре образца, вызывает скачкообразное повышение температуры на 7 - 9 °С при кипении и газо- образовании (стеклянный сосуд). Больший скачок наблюдается при более высокой температуре. Время прохождения всплеска температуры 40 - 50 с. После прохождения скачка прибор показывает темпера- туру среды, измеряемую дополнительно ртутным термометром, что свидетельствует о завершении реакции в связи с полным
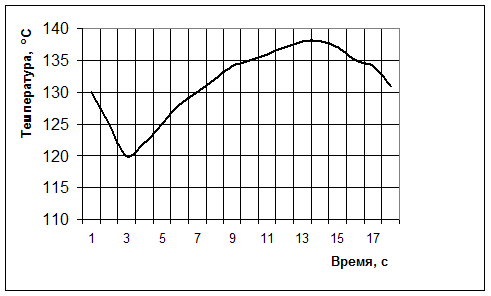
Найденному значению температурного напора (tп – td) соответствует вполне определенная интенсив- ность теплоотдачи. Для расчета теплообмена от реаги- рующей частицы к омывающей ее жидкости необходимо найти скорость естественной циркуляции потока. Эксперименты показали, что кубик сплава ФС 90 Ба4 в воде, нагретой до 90 °С, практически не реагирует. В растворе щелочи 13,3 %-ной концентрации и температуре 95 °С реакция интенсифицируется. В течении 19-20 минут сплав полностью прореагировал. При падении кассеты со сплавом ФС 90 Ба4 (d = 1·10–3 м) в раствор щелочи, температура среды в реакторе снижается на 8 - 10 °С. Индукционный период при этом составляет 3 - 5 с. Скачкообразное повышение температуры на 15 - 17 °С вызывает стремительный рост скорости реакции. Время прохождения всплеска температуры cоставило 10 - 12 с – см. рис. 4.5. На начальном этапе температура резко возрастает, затем темп роста замедляется, тем самым сказывается влияние образующегося гидроксидного слоя.
Рис. 4.5. Зависимость температуры от времени реакции сплава ФС 90 Ба4 с 13,3 %-ным раствором едкого натра (кинетический реактор), tнач = 130 °С.
После завершения скачка прибор показывает постепенное снижение температуры, что свидетельствует о завершении реакции в связи с полным разрушением частиц сплава. С учетом принятой инерционности системы, экспериментальные значения температуры реакционной поверхности (t п) оказались равными температуре кипящей жидкости при критическом давлении – см. формулу (В.21). В опыте №4 на конечной стадии реакции за 6 с температура поднялась со 130 °С до 137 °С – см. табл. 4.1. Ввиду кратковременности существования тонкого реагирующего слоя и инерционности системы реальная величина температуры составила 266 °С. Фактический скачок равен 134 °С. В пересчете на полупериод реакции (7,5 с) подъем температуры происходит от 100 °С до 194 °С, т.е. всплеск составляет 94 °С. Величина 194 °С является температурой насыщения при критическом давлении, зафиксированная в момент времени, соответствующий αr = 0,5. При повышении начальной температуры реакции для сплава ФС 90 Ба4 от 90 до 130 °С скорость выделения водорода увеличивается в 5 раз – см. табл. 4.1 и рис. 4.5, 4.6.
Рис. 4.6. Зависимость температуры от времени реакции сплава ФС 90 Ба4 с 13,3 %-ным раствором едкого натра (кинетический реактор), tнач = 90 °С.
Для сравнения были проведены исследования со сплавом на основе алюминия При взаимодействии сплава А-98КаМг с водным раствором едкого натра за 7 с температура поднялась с 88 до 95 °С - рис. 4.7. Скорость реакции равна W = 8,9∙10–3 м3/(кг∙с). Индукционный период составил 3 с. Повышение концентрации щелочи от 10 % до 13,3 % приводит к возрастанию скорости реакции – см. табл. 4.1, опыт № 7.
Рис. 4.7. Зависимость температуры от времени реакции сплава А-98 КаМг с 10 %-ным раствором едкого натра (кинетический реактор), tнач = 90 °С.
4.2.1 Оценка зависимостей по теплоотдаче
При омывании неподвижной реагирующей частицы обнаружено более существенное влияние критерия Рейнольдса для сплава ФС 90 Ба4
Nu = 0,9∙10–7 Re1,8 Pr0,33. (4.1)
Значение приведенной скорости жидкости, найденное по разработанной методике, находится в пределах 1,77 - 2,26 м/с. Числа Рейнольдса изменяются от 110000 до 160000 (табл. 4.2). Поскольку коэффициент лобового сопротивления kлс в указанном интервале возрастает (рис. В.1) – следует ожидать увеличения безразмерного коэффициента теплоотдачи с ростом чисел Рейнольдса. Установление величин температурного напора и скорости омывания частиц жидкостью позволили рассчитать осредненное значение коэффициента теплоотдачи и удельную тепловую нагрузку. Обработка экспериментальных данных проведена по известным зависимостям [98 - 101]. Расчеты выполнены на момент равный полупериоду реакции (αr = 0,5). Результаты представлены в таблице 4.2 и на рисунках 4.8 - 4.10. Оказалось, что наименьшее отклонение дает формула Кунии [99], а наибольшее – формула Кацнельсона - Тимофеевой [98]. В упомянутых работах степень влияния чисел Рейнольдса находится в пределах 0,5 - 0,58. Для активированного алюминия АГ5О5И5 (масс.%: Al - 85, Ga - 5, Sn - 5, In - 5) степень влияния числа Рейнольдса составила 1,6 [102]. Отклонение расчетных значений критерия Нуссельта от экспериментальных не превышает ± 15% [97]. С ростом скорости омывания возрастает паро- и газообразование, что сопровождается турбулизацией пограничного слоя. Близкие условия тепломассообмена наблюдаются при испарении воды в собственные перегретые пары [103].
Таблица 4.2
|


 В интервале N (1 - 14) плотность f (x) имеет постоянное значение с, а вне этого интервала равна нулю. Плотность распределения f (x) и функция распределения F (x) связаны соотношением [92]
В интервале N (1 - 14) плотность f (x) имеет постоянное значение с, а вне этого интервала равна нулю. Плотность распределения f (x) и функция распределения F (x) связаны соотношением [92]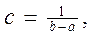

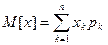 , (3.8)
, (3.8) , (3.9)
, (3.9)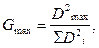 (3.11)
(3.11) (3.12)
(3.12) (3.14)
(3.14)
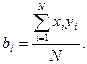 (3.15)
(3.15) (3.16)
(3.16)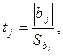 (3.17)
(3.17)
 (3.19)
(3.19)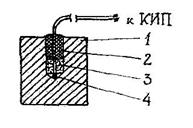 Рис. 4.1. Схема заделки спая термопары в образец:
1 - кубик сплава, 2 - эпоксидная
смола, 3 - слой хлопка, 4 - спай
термопары.
Рис. 4.1. Схема заделки спая термопары в образец:
1 - кубик сплава, 2 - эпоксидная
смола, 3 - слой хлопка, 4 - спай
термопары.

 Характер изменения температуры поверхности и центра реагирующего образца сплава ФС 90 Ба4 при исследовании реакции в открытом сосуде представлен на рисунке 4.3.
Характер изменения температуры поверхности и центра реагирующего образца сплава ФС 90 Ба4 при исследовании реакции в открытом сосуде представлен на рисунке 4.3.