Физические свойства порошков кристаллических сплавов
Кроме этого, дисперсные тела образуют огромное число морфологических типов и, например Британский институт стандартов предлагает иной перечень [88]: некруглые хлопьевидные кристаллические угловатые иррегулярные сферические зернистые почкообразные нитевидные дендритные или скелетные. Основными приборами микроструктурно-морфологического анализа порошков являются микроскопы – световые, электронные, ионные и эмиссионные. Выбор микроскопа определяется размерами исследуемых частиц и разрешающей способностью прибора. Для анализа порошков 1 - 1000 мкм рекомендуют использовать оптические микроскопы. В настоящей работе применяли стереобинокулярный микроскоп МБС-9 со специальным измерительным окуляром, снабженным линейной шкалой. Микроскопы данного типа наиболее удобны для отбора проб, оценки качества дезагрегирования и манипуляции с отдельными частицами. Они обладают значительными рабочими расстояниями и большой глубиной резкости, обеспечивают увеличение до 100 крат (МБС – от 9 до 56 крат). Микроскопический анализ фракций порошков основан на принципе статистического набора данных по размерам частиц [88 - 90]. Ниже дано описание выбранных порошков сплавов. ФС 90. Форма частиц осколочная. Рельеф поверхности изрезанный с небольшими впадинами. Частицы обладают хорошей отражающей способностью. Размер частиц от 5 мкм до 1 мм. ФС 90 Ба4. Частицы поверхности многогранной формы, обладают хорошей отражающей способностью. Размер частиц 0,1 - 2 мм. ФС 75 Ба1. Частицы имеют осколочную структуру. В некоторых местах частицы расположены углубления. Поверхность сплава имеет черный оттенок. Размер частиц 0,63 - 1 мм. ФС 75 Ба4. Частицы многогранной формы с небольшими впадинами. На отдельных поверхностях имеются фрагменты практически ровных плоскостей. Размер частиц 0,1 - 1 мм. ФСА 4. Частицы круглой формы, темно-серого цвета с небольшими треугольными гранями. В определенных местах расположены небольшие рытвины. Размер частиц 0,1 - 0,5 мм. ФСА 15 (гранулированный). Частицы шаровидной формы. По всей поверхности сплава расположены углубления. Частицы светло-серого цвета. Размер частиц 0,63 - 1 мм. ФСА 30. Частицы шаровидной формы. Тип рельефа поверхности изрезанный с рытвинами. Поверхности частиц обладают хорошей отражающей способностью. Размер частиц 0,1 - 0,5 мм. ФСА 30 Мн1. Частицы каплевидных и шаровидных форм темно-серого цвета. На отдельных поверхностях имеются выпуклости. Размер частиц 0,5 - 0,63 мм. Присутствуют отдельные частицы размером от 5 до 60 мкм. ФСА 32. Частицы круглой формы, темно-серого цвета. Вся поверхность покрыта углублениями. Размер частиц 0,63 - 1 мм. А-98КаМг. Частицы имеют шаровидную форму светло-серого цвета с небольшими впадинами на поверхности. Размер частиц 0,1 мм. АВ-86. Частицы имеют каплевидную форму светло-серого цвета. Поверхность сглажена. Размер частиц 0,63 - 1 мм. МПФ. Частицы имеют круглую форму с гладкой поверхностью серого цвета. На краях некоторых частиц присутствуют рытвины. Размер частиц 0,15 - 0,6 мм.
3.3 Методика проведения опытов
Основные кинетические исследования выполнены в реакторе, обеспечивающем изохорное ведение процесса. Схема экспериментальной установки представлена на рисунке 3.1.
Рис. 3.1. Схема экспериментальной установки для исследования изохорного процесса (кинетический реактор): 1 – реактор, 2 – горловина; 3 – кассета, 4 – металлическая нить, 5 – предохранительная мембрана, В начале опыта необходимое количество водного раствора едкого натра заливают в реактор 1. Порошок исследуемого сплава засыпают в кассету 3. Кассету подвешивают в горловине 2 на металлической нити 4, соединенной через контакт 8, пусковую кнопку 9 и выпрямитель 10 с электросетью. После герметизации и разогрева реактора нажимают кнопку 9 и одновременно фиксируют время начала реакции. Поступающий из электросети импульс тока расплавляет нить 4, кассета падает, и порошок высыпается в раствор щелочи. Производят автоматическую запись изменения давления и температуры, для чего к реактору подсоединены манометр 7 и термопара 17 с соответствующими вторичными приборами 6 и 18. Опыт считается законченным при прекращении заметного роста давления и снижения температуры среды в реакторе на 3 - 5 °С. По окончании эксперимента реактор охлаждают, газ пропускают через конденсатор 12 и, после отделения капель воды в сепараторе 13 через редуктор 14 и расходомер 15, сбрасывают в атмосферу. Продукты реакции сливают, реактор тщательно промывают. Реактор 1 снабжен контрольным манометром 11 и предохранительной мембраной 5. Температуру среды в реакторе поддерживают постоянной за счет значительного избытка раствора щелочи. При этом исключается влияние изменения концентрации щелочи в ходе реакции. Температуру измеряют термопарой типа ХК (диаметр спая 1 мм, толщина проводов 0,4 мм) и вторичным прибором КСП-4. Для записи давления применена система, состоящая из датчика давления МПЭ-МИ и самописца Н-37. Выходной сигнал тока, пропорциональный давлению, с датчика подается на усилитель (УПТ И-37), а затем регистрируется самописцем Н-37. При высоких температурах опыты проводят в следующей последовательности. В реактор подвешивают кассету, систему герметизируют и вакуумируют. Подачей определенного количества азота в реактор создают избыточное давление, предотвращающее кипение жидкости при заданной температуре. В период нагрева горловину реактора, где размещена кассета, интенсивно охлаждают. Как показали предварительные измерения, температура азота в горловине незначительно превышает температуру окружающей среды. Последнее обстоятельство позволяет резко понизить давление водяного пара в зоне горловины и, тем самым, предотвратить начало реакции в период выхода на режим. Дальнейшая последовательность ведения эксперимента не отличается от изложенной выше. Течение реакции отслеживают по повышению давления в реакторе. Количество выделившегося газа оценивают по показаниям манометра и волюметрическим методом. В поисковой серии опытов применен газовый счетчик типа ГСБ-400 (класс точности приборов см. приложение А). Степень превращения (αт) определяют, как отношение максимального фактически выделившегося объема водорода к теоретически возможному
где Vr – приведенный к н.у. объем Н2, выделившийся за время реакции; Vт – объем водорода, выделяющийся при взаимодействии 1∙10–3 кг чистого элемента (Si или Al) с водой. Для алюмокремниевых соединений Vт определяется по правилу аддитивности на активную часть сплава. Предельная относительная погрешность измерения W и αт ±2 %. Доля прореагировавшего во время опыта сплава
αт = Р τ /Рmax, (3.2)
где Р τ – давление водорода в момент времени τ; Рmax – максимальное давление к концу реакции. Предельная относительная погрешность измерения α r составляет ± 3 %. Скорость выделения водорода рассчитывают по формулам
где ∆V – приведенный к н.у. объем выделившегося водорода, м3; ∆ τ – время, за которое выделился данный объем газа, с; m – масса сплава, кг.
где f уд – удельная площадь поверхности порошка сплава, м2. Объем опытного кинетического реактора составляет 1,13∙10–3 м3. Реактор рассчитан на давление 50 МПа, масса реактора 51 кг. Количество водного раствора щелочи, заливаемого в реактор 0,5∙10–3 м3. Масса сплава, загружаемого в реактор в поисковой серии опытов 5∙10–3 кг, в основных опытах 1∙10–3 кг. После нагрева до заданной температуры электрообмотку отключают, и реактор выдерживают определенное время до установления стационарной температуры. Во время реакции температура среды повышается на 1 - 3 °С при загрузке Кинетические исследования выполнены в интервале температур 90 - 130 °С, дисперсном составе порошков сплавов (0,05 - 1,5)∙10–3 м, концентрации щелочи
3.4 Результаты кинетических исследований
Поисковая серия экспериментов проведена с целью определения оптимальных параметров процесса. Для разогрева кинетического реактора использовали электрообмотку. Нижний предел нагрева реактора установлен в экспериментах со сплавом ФСА 30. Опыты показали, что синтетический сплав ФСА 30 является инертным при температуре 25 °С и концентрации едкого натра 10 %. При повышении температуры до 45 °С и концентрации NaOH 13,3 % полнота реакции (α) для ФСА 30 не превышает 0,15 - 0,2. Последнее обстоятельство свидетельствует о начале взаимодействия алюминия с раствором щелочи. При концентрации NaOH 10 % и температуре 80 - 90 °С полнота реакции составляет 28 - 30 %. Это говорит о том, что кремний вступает в реакцию при 70 - 80 °С. С повышением температуры до 130 °С и концентрации NaOH 13,3 % полнота реакции составляет 0,6 - 0,65 %. Электрическая обмотка позволяет разогреть реактор до 185 °С. Результаты основной серии опытов представлены в таблицах 3.3 - 3.5 и на рисунках 3.2 - 3.6. В основной серии опытов проведено сравнение сплавов ФСА 4, ФСА 15, ФСА 30, ФСА 30 Мн1, ФСА 30, ФС 90 и сплавов с добавками бария ФС 90 Ба4, ФС 75 Ба1, ФС 75 Ба4.
Таблица 3.3 Зависимость скорости выделения водорода и полноты реакции сплавов ФСА и ФС от концентрации щелочи и начальной температуры реакции tнач = 90 ºС. Дисперсный состав (0,5 - 1,5)∙10–3 м, m = 5∙10–3 кг.
Таблица 3.4 Зависимость скорости выделения водорода и полноты реакции сплавов ФСА и ФС от концентрации щелочи при tнач = 130 ºС. Дисперсный состав (0,5 - 1,5)∙10–3 м, m = 5∙10–3 кг.
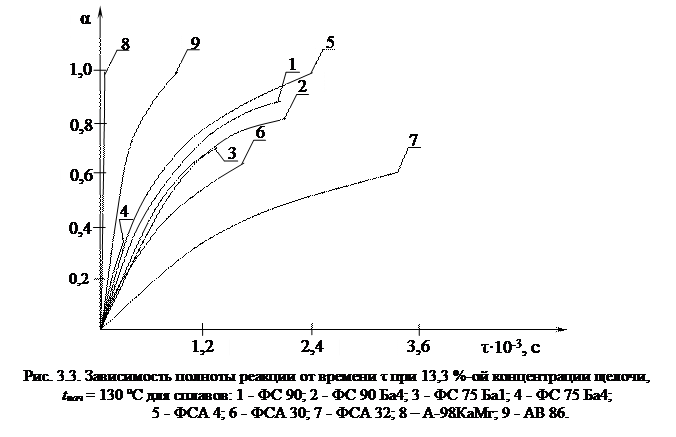
Обобщение кинетических данных уравнением Ерофеева позволило определить коэффициенты n и k – формула 1.37. Результаты представлены в таблице 3.5 и на рисунках 3.5, 3.6. Таблице 3.5 соответствуют рисунки 3.4 - 3.6. Номера прямых соответствуют порядковым номерам в таблице. Таблица 3.5 Зависимость скорости выделения водорода и полноты реакции от температуры для сплавов ФСА и сплавов ФС. Концентрация щелочи 13,3%, дисперсный состав (0,1 - 0,5)∙10–3 м,
В таблице 3.5 и на рисунках 3.5, 3.6 отражены реакции взаимодействия сплавов ФС и ФСА с раствором щелочи концентрацией 13,3 %. Синтетический сплав ФСА 15 на начальной стадии имеет константу скорости к = 10,7 и показатель n = 1,88. При αт = 0,41 наблюдается перелом прямой, после которого коэффициенты принимают значения к = 53,8; n = 1,23. Уменьшение показателя n после перелома обусловлено сокращением реакционной поверхности как вследствие исчезновения мелких частиц, так и за счет зарастания более крупных частиц гидроксидным слоем [73]. Измельчение порошка фракции (0,5 - 1,5)∙10–3 м до (0,1 - 0,5)∙10–3 м увеличивает скорость реакции более чем в 1,5 раза – см. табл. 3.4, 3.5. При длительном хранении порошков сплавов измельчение менее Сплавы ферросилиция ФС 90 и ФС 90 Ба4 обладают более высокой скоростью и полнотой реакции, чем сплавы ферросиликоалюминия ФСА 15, ФСА 30, ФСА 30 Мн1, ФСА 32 изготовленные сплавлением чистых компонентов. Наилучшими характеристиками обладает сплав ФС 90: максимальная скорость газовыделения Wmax = 3,49∙10–3 м3/кг∙с, полнота реакции αт = 0,91 при дисперсном составе (0,1 - 0,5)∙10–3 м и 13,3 % NaOH. Высокая активность ФС 90 обусловлена наличием в своем составе кальция и алюминия. Это влечет за собой увеличение скорости выделения водорода и полноты реакции. В тех же условиях сплав ФСА 15 имеет скорость Wmax = 0,19∙10–3 м3/кг∙с и полноту реакции αт = 0,53. При 10 %-ной концентрации щелочи ФC 90 имеет скорость газовыделения При повышении температуры с 90 до 130 C скорость реакции значительно возрастает для сплавов с содержанием кремния более 75 % (ФС 90, ФС 90 Ба4, ФС 75 Ба1, ФСА 4, ФСА 15), но несколько снижается для сплавов на основе алюминия А-98КаМг и АВ 86. Уменьшение скорости, по-видимому, связано с режимом размывания гидроксида алюминия, образующегося на поверхности частиц. Алюминиевый сплав АВ 86 взаимодействует с водой мгновенно, однако образующийся гидроксид с некоторого момента начинает интенсивно поглощать воду. С исчезновением воды реакция затухает – см. табл. 3.3, опыт № 14. Поэтому алюминиевые сплавы требуют двухкратного увеличения расхода воды. На рисунках 3.2 - 3.4 и в таблицах 3.3 - 3.5 даны результаты исследования кинетики взаимодействия сплава на основе алюминия А-98КаМг с раствором едкого натра. Наиболее интенсивная реакция наблюдается при температуре 90 °С, что обусловлено высоким содержанием алюминия. Аналогичное явление, особенно при низких температурах, наблюдается для сплавов ФСА 30 Мн1 и ФСА 32 с содержанием алюминия более 30 %. Поэтому желательно ограничить концентрацию алюминия в сплавах ФСА на уровне 25 - 30 %. Результаты опытов со сплавами ФС 90 и ФС 90 Ба4, содержащие железо и кальций, показывают повышение скорости взаимодействия с водным раствором едкого натра. С увеличением температуры кальций быстро вытесняет водород из воды образуя дигидроксид Са(ОН)2 – см. табл. 3.3, 3.4. Однако скорость газовыделения увеличивается лишь при относительно небольших добавках железа 3 - 5 % и кальция 1 - 10 % [91]. С уменьшением концентрации щелочи с 13,3 до 10 %, при одинаковой температуре, полнота реакции для сплава ФС 90 Ба4 выше, чем для ФС 90 – см. табл. 3.3. Это свидетельствует о том, что барий при взаимодействии с водой образует свою щелочную среду, что позволяет снизить расход едкого натра на 10 -15 % и увеличить объем выделившегося водорода. Увеличение температуры от 90 до 130 °С приводит к увеличению полноты реакции для большинства сплавов в 1,5 - 2 раза. Одновременно значительно увеличивается и скорость реакции. Дело в том, что железо, кальций, барий и другие примеси образуют с кремнием достаточно прочные соединения, среди них наиболее устойчивы дисилициды этих металлов. С повышением температуры дисилициды удается разрушить. Сплав ФС 75 Ба1 значительно активнее ФС 75 Ба4. Это обусловлено тем, что с увеличением содержания алюминия от 2 до 10 % газовыделение в сплавах с добавками бария снижается на 40 - 45 % [78].
При одной и той же температуре большим абсолютным значениям энергии Гиббса должны соответствовать более высокие скорости реакции W. В связи с этим W целесообразно представить через термодинамические потенциалы. Величины, объединяемые уравнением (1.31) даны в таблице 3.5.8 [37] и таблицах 3.6, 3.7. В табл. 3.7 изменения энергии Гиббса найдены по табулированным значениям термодинамических величин [43]. Таблица3.6
|


 αт = Vr/Vт, (3.1)
αт = Vr/Vт, (3.1) , (3.3)
, (3.3)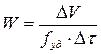 , (3.4)
, (3.4)




 Характер роста давления в кинетическом реакторе при взаимодействии сплавов с водным раствором едкого натра приведен на рисунке 3.7.
Характер роста давления в кинетическом реакторе при взаимодействии сплавов с водным раствором едкого натра приведен на рисунке 3.7.


