Ход определения
Во флаконы из-под пенициллина вносят 0,5 мл трихлоруксусной кислоты, 0,5 мл раствора пропанола, 0,5 мл раствора этилового спирта различной концентрации (0,4; 2,0; 4,0‰) и 0,5 мл исследуемой пробы. Флаконы закрывают стандартными пробками, пробки фиксируют. Содержимое флаконов перемешивают и шприцем вводят по 0,35 мл раствора нитрита натрия. Флаконы энергично встряхивают (30 маятникообразных движений) и оставляют на 1 минуту. После чего из каждого флакона шприцем путем прокола пробки отбирают 0,5 мл парогазовой фазы, которую тотчас же вводят в дозатор прибора и хроматографируют. Для получения достоверных результатов проводят три параллельных исследования. На полученных хроматограммах должны быть проставлены ФИО освидетельствуемого, номер акта медицинского освидетельствования или номер медицинской карты стационарного или амбулаторного больного, дата и время исследования. На градуировочном графике по оси абсцисс откладываются значения отношения высот пиков этилнитрита к пропилнитриту. Во избежание дробных чисел среднее значение соотношения высот пиков для каждой концентрации этанола умножают на 100 (масштаб: 1см = 0,1). По оси ординат откладывают соответствующие им значения концентрации эталонных растворов (масштаб: 1 см = 0,4 ‰.). Для расчета концентрации этилового спирта удобнее пользоваться величиной fR – фактор чувствительности, который рассчитывается по формуле:
где С – концентрация исследуемого вещества, г/л; hst – высота пика внутреннего стандарта, см; hx – высота пика исследуемого вещества, см; n – число текущих измерений; fR – постоянная величина для данной пары веществ на каждой колонке, зависящая от летучести определяемых соединений при условиях опыта. Концентрацию этилового спирта соответственно определяют по формуле:
Для вычисления концентрации этанола в исследуемых пробах необходимо полученную концентрацию умножить на коэффициенты пересчета: для крови – 0,95, для мочи – 1,05. Определение этилового алкоголя в крови и моче фотометрическим методом Сущность фотометрического метода заключается в восстановлении калия бихромата в кислой среде этанолом, ускоренно диффундирующим из объекта под действием калия карбоната. В зависимости от концентрации этанола раствор калия бихромата изменяет окраску от светло-оранжевой до темно-синей. По градации переходных оттенков фотометрированием по отношению к эталонным растворам этилового спирта и к контрольной пробе определяется концентрация этанола в исследуемых объектах. Использование трех растворов: калия бихромата в серной кислоте, калия перманганата, мета-нитробензальдегида в серной кислоте позволяет установить наличие или отсутствие этилового спирта. Каждый из указанных растворов приобретает различную окраску. При наличии этанола раствор калия бихромата изменяет окраску от светло-оранжевой до темно-синей; калия перманганата – от красно-фиолетовой до буроватой; раствор мета-нитробензальдегида не изменяет окраску. При наличии метанола раствор калия бихромата восстанавливается значительно интенсивнее, примерно в 4 раза, чем в присутствии этанола, окраска растворов калия перманганата и мета-нитробензальдегида не изменяется. При наличии пропиловых, бутиловых, амиловых спиртов окраска калия бихромата и калия перманганата изменяется примерно как и от этанола, но раствор мета-нитробензальдегида резко изменяет окраску до красной или коричневой (при концентрации менее 0,2‰). Этиловый эфир, анилин, ментол, ацетон, ацетальдегид, формальдегид вызывают другие окрашивания указанных реактивов. Пиридин, аммиак, четыреххлористый углерод, нитробензол, дихлорэтан, этиленгликоль не влияют на цвет растворов реактивов.
|

 (4)
(4)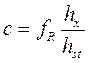 (5)
(5)


