ББК 24.1 8 страница. Пример 20. Вычислить рН раствора сульфата аммония концентрацией 0,1 моль/л.
Пример 20. Вычислить рН раствора сульфата аммония концентрацией 0,1 моль/л. Решение. Составим ионное уравнение гидролиза: NH4+ + H2O ® NH4OH + H+. Значение константы диссоциации гидроксида аммония Kd = 1,76×10-5. Вычислим константу гидролиза
Найдем концентрацию ионов аммония. Согласно уравнению диссоциации сульфата аммония (NH4)2SO4 ® 2 NH4+ + SO42-,
Вычислим концентрацию ионов
и рН = –lg[H+] = –lg(1,066×10-5) = 4,97. Пример 21. вычислить степень гидролиза карбоната натрия в растворе с рН = 12. Решение. Составим ионное уравнение гидролиза: CO32- + + H2O ® HCO3- + OH-. Вторая константа диссоциации угольной кислоты Kd 2 = 4,69×10-11. Первая константа гидролиза по уравнению (4.20)
Из формулы
где [OH-] = 10-pOH = 10-(14-12) = 10-2. Вычислим степень гидролиза
Задание XII. Составить молекулярные и ионные уравнения гидролиза, указать характер среды.
Задание XIII. Написать в молекулярном и ионном виде реакции взаимоусиления гидролиза 613. Ацетат меди + сульфит лития. 614. Ацетат свинца + карбонат натрия. 615. Ацетат цинка + сульфит натрия. 616. Нитрат алюминия + карбонат натрия. 617. Нитрат висмута + сульфид калия. 618. Нитрат железа (III) + сульфид рубидия. 619. Нитрат свинца + карбонат стронция. 620. Нитрат серебра + карбонат натрия. 621. Нитрат хрома (III) + сульфид калия. 622. Сульфат алюминия + сульфид натрия. 623. Сульфат бария + сульфит цезия. 624. Сульфат кобальта + карбонат калия. 625. Сульфат олова + карбонат цезия. 626. Формиат алюминия + карбонат натрия. 627. Формиат меди + сульфит лития. 628. Формиат цинка + сульфид лития. 629. Фторид алюминия + карбонат калия. 630. Хлорид железа (II) + сульфид натрия. 631. Хлорид магния + сульфит рубидия. 632. Хлорид марганца + сульфит натрия. 633. Хлорид никеля + карбонат цезия.
Задание XIV. Найти неизвестные величины в предложенных задачах, дополнив табл.4.8.
Таблица 4.8
Окончание табл.4.8
4.5. Равновесия в буферных растворах
Буферные растворы – растворы, способные поддерживать определенное значение рН при разбавлении, а также при добавлении некоторых количеств сильной кислоты или щелочи. Буферное действие основано на связывании добавляемых ионов Н + или ОН - в молекулы малодиссоциированных соединений. Различают следующие типы буферных растворов: · Смесь слабой кислоты и ее соли (например, уксусная кислота СН3СООН + ацетат натрия NaCH3COO). При добавлении сильной кислоты к этому раствору анионы соли связывают ионы Н + в молекулы малодиссоциированной уксусной кислоты: СН3СОО- + Н+ Û СН3СООН. При добавлении щелочи протекает реакция нейтрализации: СН3СООН + ОН- Û СН3СОО- + Н2О и раствор имеет
где p Kd – показатель константы диссоциации слабой кислоты, p Kd = –lg Kd; С с и С к – концентрации соли и килоты соответственно, моль/л. · Смесь средней и кислой соли или двух кислых солей слабой многоосновной кислоты (например, Na2CO3 + NaHCO3 или Na2HPO4 + NaH2PO4). Анионы кислой соли реагируют подобно слабой кислоте:
где С с и С к – концентрации кислой и средней соли соответственно, моль/л. · Кислые соли слабых многоосновных кислот, при добавлении к растворам которых сильных кислот или щелочей, протекают аналогичные реакции: НСО3- + Н+ Û Н2СО3; НСО3- + ОН- Û СО32- + Н2О;
где p Kn – показатель константы диссоциации кислоты по соответствующей ступени. · Смесь слабого основания и его соли (например, NH4OH + + NH4Cl). Буферное действие основано на реакциях NH4OH + H+ Û NH4+ + H2O; NH4+ + OH- Û NH4OH. Показатель
где p Kd – показатель константы диссоциации слабого основания; С с и С осн – концентрации соли и основания соответственно, моль/л. · Соли слабых кислот и слабых оснований (например, NH4CH3COO). Буферное действие обусловлено реакциями NH4+ + OH- Û NH4OH; CH3COO- + H+ Û CH3COOH. Емкостью буферного раствора В называют количество сильной кислоты или щелочи, которое требуется добавить к 1 л раствора для изменения его рН на единицу. Раствор утрачивает буферные свойства при добавлении сильной кислоты или щелочи в количестве, превышающем буферную емкость. Различают буферную емкость раствора по кислоте и по щелочи. Емкость кислого буфера по щелочи вычисляют по уравнению
Таким образом,
Из уравнения
вычислим емкость кислого буфера по кислоте
Емкости основного буфера по кислоте и по щелочи соответственно
Отношение С с/ С к или С с/ С осн выбирают в пределах 0,1 < С с / С к < 10. По таблицам констант диссоциации (см. прил.1) подбирают слабую кислоту с p Kd = pH ± 1(или слабое основание с p Kd = pOH ± 1). Исходя из заданного рНвычисляют отношение концентраций С с / С к (или С с / С осн). Пример 22. Вычислить изменение рН ацетатного буферного раствора, содержащего по 1 моль/л кислоты и соли, после добавления к 1 л раствора 0,1 моль соляной кислоты. Решение. Вычислим рН данного буферного раствора по формуле (4.22):
После добавления к буферному раствору соляной кислоты концентрация ацетата натрия уменьшится, а концентрация уксусной кислоты увеличится на 0,1 моль/л вследствие протекания реакции CH3COONa + HCl ® CH3COOH + NaCl. Вычислив для нового раствора
найдем ΔрН = 4,75 - 4,66 = 0,09. Пример 23. К 0,8 л 0,5 М раствора НСООН (Kd = 1,8×10-4) добавили 0,2 л 0,4 М раствора NaOH. Вычислить рН образовавшегося формиатного буфера и его буферную емкость по кислоте и щелочи. Решение. Количество вещества НСООН и NaOH соответственно
Объем буферного раствора
Количество вещества формиата натрия, образующегося по реакции NaOH + HCOOH ® HCOONa + H2O,
Остаточное количество вещества муравьиной кислоты
Ее молярная концентрация в буферном растворе
Буферный раствор имеет
Буферная емкость по кислоте согласно уравнению (4.24)
Буферную емкость по щелочи определим при помощи уравнения (4.23):
Пример 24. Сколько граммов твердого формиата натрия HCOONa надо добавить к 100 мл 0,2 М раствора соляной кислоты, чтобы получить буферный раствор с рН = 4,3? Решение. При добавлении к раствору соляной кислоты формиата натрия образуется муравьиная кислота по реакции HCOONa + HCl ® HCOOH + NaCl. Ее концентрация С (HCOOH) = С (HCl) = 0,2 моль/л. Для образования формиатного буферного раствора необходима определенная концентрация формиата натрия, которую найдем исходя из формулы (4.22):
откуда Количество вещества формиата натрия, необходимого для получения данного буферного раствора,
его масса
Задание XV. Решить задачи. 684. К 200 мл 0,5 н. раствора уксусной кислоты добавили 10 мл 0,8 н. раствора едкого натра. Определить рН полученного раствора. 685. Какой объем 20-процентного раствора уксусной кислоты плотностью 1,026 г/см3 следует прилить к 1 л 0,075 н. раствора ацетата натрия, чтобы получить буферный раствор с рН = 2,75? 686. Рассчитать рН раствора, содержащего 1,5 моль/л ацетата натрия и 0,75 моль/л уксусной кислоты. Как изменится величина рН при добавлении к 50 мл этого раствора 1 мл 2 н. раствора едкого натра? 687. Сколько граммов безводного бензойнокислого натрия необходимо прибавить к 100 мл 0,02 моль/л раствора бензойной кислоты С6Н5СООН, чтобы получить буферный раствор с рН = 5? 688. К 25 мл 2-процентного раствора гидроксида аммония плотностью 0,99 г/см3 добавили 1,5 г хлорида аммония. Определить рН полученного раствора, если его плотность равна 1,01 г/см3. 689. Как изменится рН в 0,1 н. растворе уксусной кислоты после добавления к нему кристаллического ацетата натрия до концентрации 0,1 моль/л? 690. Как изменится рН раствора, полученного смешиванием 100 мл 5-процентного раствора муравьиной кислоты плотностью 1,008 г/см3 и 100 мл 7-процентного раствора формиата калия плотностью 1,01 г/см3, если к нему прилить 50 мл 0,2 н. раствора едкого калия? 691. Какой объем 20-процентного раствора фосфорной кислоты (плотность 1,113 г/мл) надо добавить к 2 л раствора едкого кали с концентрацией 0,2 моль/л для получения буферного раствора с рН = 6? 692. Как изменится рН раствора, содержащего в 200 мл 2,14 г хлорида аммония и 2,1 г гидроксида аммония, в результате добавления к нему 10 мл 2 н. раствора соляной кислоты? 693. Какой объем раствора гидроксида бария концентрацией 0,5 моль/л следует добавить к 1,5 л 5-процентного раствора уксусной кислоты плотностью 1,006 г/см3, чтобы получить буферный раствор с рН = 4? 694. Рассчитать рН раствора, полученного смешиванием 10 м3 2-процентного раствора едкого натра (плотность 1,021 г/см3) и 15 м3 5-процентного раствора фосфорной кислоты (плотность 1,026 г/см3). 695. Какой объем 20-процентной серной кислоты (плотность 1,139 г/мл) необходимо добавить к 5 л раствора этиламина с концентрацией 0,02 моль/л для получения буферного раствора с рН = 9,8? 696. К 5 л 5-процентного раствора гидроксида аммония плотностью 0,986 г/мл добавили 10 л 3-процентного раствора серной кислоты плотностью 1,019 г/мл. Определить рН полученного раствора. 697. Определить рН борно-натриевого буферного раствора (концентрация Н3ВО3 и NaH2BO3 15 и 10 % соответственно, средняя плотность раствора 1,12 г/см3). 698. Рассчитать рН раствора, полученного путем поглощения 20 л углекислого газа 6 л раствора едкого натра с концентрацией 0,1 моль/л. Процесс вели при температуре 25 °С и давлении 1 атм. 699. Определить рН фосфорно-натриевого буфера, если в 1 л раствора содержится 19,6 г фосфорной кислоты и 30 г дигидрофосфата натрия. 700. Объем хлористого водорода, равный 5 м3, был измерен при температуре 100 °С и давлении 1,5 атм. Определить рН раствора, полученного в результате поглощения этого газа 5 м3 раствора гидроксида аммония с концентрацией 0,1 моль/л. 701. Рассчитать рН раствора, в 1 л которого содержится 12,5 г ацетата натрия и 17,5 г уксусной кислоты. 702. Какой объем аммиака должен быть поглощен при 25 °С и давлении 1 атм 2-процентным раствором серной кислоты плотностью 1,012 г/мл в количестве 300 мл, чтобы полученный раствор имел рН = 10? 703. Каков рН аммиачно-хлоридного буфера, содержащего в 1 л 70 г гидроксида аммония и 26,7 г хлорида аммония? 704. Какой объем раствора аммиака (концентрация 4,27 %, плотность 0,98 г/см3) надо добавить к 200 мл 0,1 н. раствора соляной кислоты, чтобы получить буферный раствор с рН = 8,24? 705. Рассчитать рН смеси карбоната и гидрокарбоната калия с концентрацией по 0,02 моль/л. 706. Какой объем раствора уксусной кислоты (концентрация 6 %, плотность 1,007 г/см3) следует долить к 100 мл раствора едкого натра (концентрация 0,6 %, плотность 1,005 г/см3), чтобы получить буферный раствор с рН = 4,18? 707. Рассчитать рН раствора дигидрофосфата натрия с концентрацией 1 моль/л. 708. Сколько граммов гипобромита натрия NaBrO следует добавить к 10 л 0,5 н. раствора бромноватистой кислоты, константа диссоциации которой равна 2,06×10-9, чтобы получить буферный раствор с рН = 6,74? 709. Рассчитать рН раствора гидросульфида калия с концентрацией 1 моль/л. 710. Какой объем аммиака должен быть поглощен при 25 °С и давлении 1 атм 2-процентным раствором соляной кислоты (плотность 1,008 г/см3) в количестве 300 мл, чтобы полученный раствор имел значение рН = 10? 711. Каково значение рН аммиачно-хлоридного буфера, содержащего в 1 л 70 г гидроксида аммония и 26,7 г хлорида аммония? 712. Как изменится рН СН3СООН в 0,2 М растворе, если к 100 мл этого раствора прибавили 30 мл 0,3 М раствора ацетата натрия? 713. Рассчитать рН полученного раствора, если к 100 мл 0,0375 М СН3СООН прибавили 0,102 г CH3COONa. 714. Вычислить рН раствора, полученного смешиванием 25 мл 0,2 М СН3СООН и 15 мл 0,1 М CH3COONa. 715. Вычислить рН полученного раствора, если в 1 л воды содержится 60,05 г СН3СООН и 82,03 г CH3COONa. 716. Вычислить рН раствора, если к 2 л воды прибавили 23 г НСООН и 21 г НСООК. 717. Вычислить рН раствора, полученного смешиванием 15 мл 0,1 М НСООН и 12 мл 0,2 М HCOONa. 718. Какой объем 0,2 М NaOH надо прибавить к 40 мл 0,1 М раствора лимонной кислоты, чтобы получить раствор с рН = 3,0? 719. Какой объем раствора NaOH (концентрация 0,4 %) надо прибавить к 23 мл 0,2 М раствора ортофосфорной кислоты, чтобы получить раствор с рН = 2,3? 720. Какую массу гидроксида натрия надо растворить в 100 мл 0,1 М раствора гидрокарбоната натрия, чтобы получить раствор с рН = 10? 721. Какую массу гидрокарбоната натрия надо растворить в 30 мл раствора гидроксида натрия (концентрация 1 %), чтобы получить раствор с рН = 10,0? 722. Как изменится рН 1-процентного раствора НСООН, если к 230 мл этого раствора прибавить 540 мл раствора НСООK концентрацией 0,5 %? 723. Сколько миллилитров 0,2 М HCl надо добавить к 50 мл 0,1 М Na2CO3, чтобы получить раствор с рН = 10,5?
4.6. Равновесия в насыщенных растворах Насыщенным называют раствор, находящийся в равновесии с избытком растворяемого вещества. Концентрацию насыщенного раствора называют растворимостью и обозначают S. Растворимость зависит от температуры и состава раствора. Рассмотрим равновесие между солью, состоящей из катионов металла Mz + и анионов кислотного остатка Az -, и ее насыщенным раствором. При этом учтем, что все соли – сильные электролиты, полностью диссоциирующие в растворе: Мn+Аn-(т) Û n+М z +(р-р) + n-А z -(р-р). (4.25) Константу данного равновесия называют произведением растворимости соли и обозначают L. Согласно закону действующих масс L = [M z +] n +[A z -] n -. (4.26) Это выражение используют для расчета концентрации ионов в насыщенных растворах. Значения произведений растворимости обычно берут в справочнике (прил.3). Бинарная система соль – вода. Согласно уравнению (4.25), [M z +] = n +S и [A z -] = n- S. Подставив эти соотношения в (4.26), получим L = (n +S)n + (n -S)n - = (n± S)n, где n± = (n+n+×n-n-)1/n; n = n+ + n-. Таким образом, растворимость соли в воде
Многокомпонентная система с одноименными ионами. Рассмотрим расчет растворимости соли Мn+Аn - в системе, содержащей хорошо растворимую соль М¢Аn¢ с одноименным анионом (например, BaSO4–Na2SO4–H2O). Катионы M z + переходят в раствор только из осадка, поэтому их концентрация определена растворимостью: [M z +] = n+ S. Концентрация анионов в растворе складывается из двух составляющих: растворимости труднорастворимой соли n -S и концентрации соли М¢An¢, которую обозначим n¢ С ¢. После подстановки в формулу (4.26) запишем
|





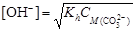 найдем концентрацию карбонат-иона
найдем концентрацию карбонат-иона ,
,
 ,
,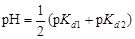 ,
,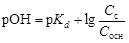 ,
, .
. (4.23)
(4.23)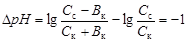
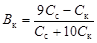 . (4.24)
. (4.24)
 .
.






 моль. Молярная концентрация формиата натрия в буферном растворе
моль. Молярная концентрация формиата натрия в буферном растворе моль/л.
моль/л.
 .
. моль/л.
моль/л.


 ,
, моль/л.
моль/л. моль,
моль, г.
г. .
.


