Общие сведения. Окислительно-восстановительными называют реакции, протекающие с изменением степени окисления элементов.
Окислительно-восстановительными называют реакции, протекающие с изменением степени окисления элементов. Степень окисления – это гипотетический заряд, который был бы на атомах данного элемента, если бы соединение было построено из ионов. Высшая степень окисления элемента равна номеру группы периодической системы, в которой данный элемент расположен. Низшая отрицательная степень окисления равна числу электронов, которое может принять данный элемент на застраивающийся np-подуровень: zmin = N – 8, где N – номер группы. Например, у серы высшая степень окисления равна 6, а низшая: 6 – 8 = −2. В простых веществах степень окисления равна нулю. Многие элементы проявляют в соединениях постоянные значения степени окисления: фтор −1; кислород −2, кроме пероксидов, в которых степень окисления кислорода −1; щелочные металлы +1; щелочноземельные металлы +2; водород, кроме гидридов и органических соединений, +1. Степени окисления переменновалентных элементов рассчитывают по правилу баланса зарядов: «сумма степеней окисления всех элементов в соединении равна нулю, а в многоатомном ионе – заряду иона». Например, в дихромате калия K2Cr2O7 согласно балансу зарядов
следовательно, подставив z K = 1 и z O = −2, получаем z Cr = +6; в перманганат-ионе Окислителем называют элемент, который в ходе реакции понижает степень окисления, а восстановителем – элемент, который повышает степень окисления. Окислитель при этом принимает электроны на валентную оболочку, а восстановитель отдает электроны. Правила составления уравнений окислительно-восстановительных реакций следующие. Возьмем в качестве примера восстановление перманганата нитритом калия в нейтральной среде:
Определяют степени окисления переменновалентных элементов, окислитель и восстановитель. Калий, кислород и водород имеют постоянные значения степеней окисления, указанные выше. По балансам зарядов вычисляем z Mn = +7, z N = +3. Поскольку марганец в высшей степени окисления, равной номеру группы, он является окислителем. Азот может повысить степень окисления до номера группы +5, поэтому он является восстановителем. Составляют ионные уравнения полуреакций окисления и восстановления. Для уравнивания числа атомов кислорода добавляют воду и ионы: H+ в кислой среде или ОН- в щелочной среде. Восстановление: Окисление: Приводят число электронов к наименьшему общему кратному, в примере к 6. Для этого уравнения полуреакций домножают на соответствующие коэффициенты, в примере на 2 и 3. Суммируют уравнения полуреакций, сокращая одинаковые члены в левой и правой частях и учитывая нейтрализацию Н+ + ОН- = Н2О. В результате получают ионное уравнение реакции:
Составляют молекулярное уравнение реакции путем добавления к ионам имеющихся в растворе противоионов:
Глубина восстановления перманганата зависит от кислотности среды. В кислой среде перманганат восстанавливается до степени окисления +2 согласно полуреакции:
В нейтральной среде, ввиду недостатка ионов Н+, восстановление идет до MnO2 по приведенной в примере полуреакции. В щелочной среде восстановление заканчивается уже на стадии образования Mn(6+) в форме манганат-иона
От кислотности среды зависит также состояние в растворе хрома (VI) вследствие протекания реакций:
Cогласно принципу Ле-Шателье, в кислой среде, при избытке ионов Н+, равновесие смещается влево, и хром находится в растворе в форме оранжевого дихромата. В щелочной среде, когда ионы Н+ в недостатке, равновесие смещено вправо, и хром переходит в форму желтого хромата. Окислительная способность хрома (VI) выше в кислой среде. Дихромат – сильный окислитель, восстанавливающийся по полуреакции:
Хромат – слабый окислитель, поэтому хром (VI) получают обычно окислением хрома (3+) в щелочной среде по полуреакции:
|

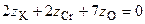 ,
,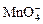 z Mn + 4 z O = −1, следовательно, z Mn = +7.
z Mn + 4 z O = −1, следовательно, z Mn = +7.
 .
. .
. .
.
 .
. . Уравнение полуреакции:
. Уравнение полуреакции: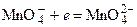 .
.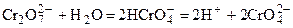 .
. .
. .
.


