Реакции образования солей и комплексных соединений
Неорганические соли железа (II), меди (I), серебра, кобальта, ртути (II), кадмия, свинца, сурьмы широко используют для испытания подлинности органических соединений: карбоновых кислот (в том числе аминокислот, оксикислот), производных барбитуровой кислоты, спиртов, фенолов, сульфаниламидов, некоторых алкалоидов, гормонов, антибиотиков. В результате реакции образуются соответствующие соли или комплексные соединения за счет наличия в молекулах карбоксильной группы, фенольного гидроксила, имидной группы, вторичной аминогруппы и спиртового гидроксила. Для идентификации пользуются реакцией нейтрализации натриевых (калиевых) солей органических кислот (бензойной. салициловой и др.): R – COONa + HCI®R – COOH + HCI Выделившиеся нерастворимые в воде кислоты осаждаются. Затем их идентифицируют по температурам плавления или цветным реакциям с ионами тяжелых металлов. Если лекарственное вещество мало растворимо в воде, его вначале превращают в натриевую соль или соль аммония, а затем выполняют реакцию с солями тяжелых металлов.
Окрашенные соединения железа (III) с салицилат- и аминосалицилат ионами обусловлены наличием фенольного гидроксила и карбоксильной группы. Состав и свойства полученных соединений зависят от рН. Так, при рН=1 образуется комплекс состава I:I
COO и при рН=7.4 желтый (1:3). Хлорид железа (III) образует окрашенные соли с ацетат-, глюконат-ионами, терпингидратом (п-ментадиолом - 1.8).(См. табл.3.) Из комплексных соединений в качестве реактива наиболее широко используется нитропруссид натрия Na2 [Fe(CN)5 NO] • 2Н2О, который образует характерные окрашенные продукты с различными органическими лекарственными веществами. Окраска возникает вследствие замещения нитрозогруппы в ионе нитропруссида, например» кетонами: o ║ O CH3-C-R ║ Na2[Fe(CN)5NO]――® Na2[Fe(CN)2CH2-C-R] Окрашенные соединения образуют также альдегиды, фенолы, аминопроизводные, тиосемикарбазоны. Нитропруссид натрия применяют в фармакопейном анализе для испытания подлинности производных тиосемикарбазона (метисазон), сульфаниламидов (стрептоцид растворимый, норсульфазол, сульфадимезин, сульфадиметоксин и др.); производных имидазола (нафтизин), тиоурацила (метилтиоурацил) и др. Нитропруссид натрия дает характерные цветные реакции с некоторыми алкалоидами (пилокарпин, теофеллин, пахикарпин, сферофизин, сальсолин).
|

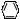 Один из наиболее широкоупотребляемых реактивов FeCI3, взаимодействуя с фенолами образует комплексные ионы фенолятов железа [ - OFe]2+, окрашенные в синий или фиолетовый цвет (фенол, резорцин). Установлено, что наличие карбонильной или некоторых других групп в орто-положение к фенольному гидроксилу обуславливают фиолетовую окраску; в пара-положении - желтую или красную; мета - замещенные фенолы не образуют окрашенных соединений. Если фенольный гидроксил связан в сложноэфирную группу органической кислотой, то необходимо предварительное гидролитическое расщепление эфирной связи.
Один из наиболее широкоупотребляемых реактивов FeCI3, взаимодействуя с фенолами образует комплексные ионы фенолятов железа [ - OFe]2+, окрашенные в синий или фиолетовый цвет (фенол, резорцин). Установлено, что наличие карбонильной или некоторых других групп в орто-положение к фенольному гидроксилу обуславливают фиолетовую окраску; в пара-положении - желтую или красную; мета - замещенные фенолы не образуют окрашенных соединений. Если фенольный гидроксил связан в сложноэфирную группу органической кислотой, то необходимо предварительное гидролитическое расщепление эфирной связи. O-Fe + фиолетовый, при рН=2,5 - красный (1:2)
O-Fe + фиолетовый, при рН=2,5 - красный (1:2)


