Введение. В двигателях внутреннего сгорания происходят сложные физико-химические процессы, обусловленные превращением тепловой энергии в механическую
В двигателях внутреннего сгорания происходят сложные физико-химические процессы, обусловленные превращением тепловой энергии в механическую. Особенности указанного вида превращения энергии изучаются методами термодинамики. Практическое освоение методов термодинамики позволяет глубже понять закономерности процессов, сопровождающих работу конкретных двигателей, выяснить, основные предельные технические характеристики и сопоставить их с реально наблюдаемыми. Цель выполнения контрольных работ - углубление и обобщения полученных знаний, приобретение навыков решения практических задач с использованием учебной и справочной литературы. Компетенции обучающегося, оцениваемые по результатам выполнения контрольных работ - готовность применять фундаментальные законы природы и основные физические законы в педагогической области (ОК-17); знание устройства, принципов работы агрегатов, механизмов и узлов современных транспортных и технологических машин (ПСК-1.3), знание основ термодинамики и рабочих процессов двигателей внутреннего сгорания (ПСК 1.16). Выполнения заданий контрольных работ обеспечивает формирование у студентов знаний и умений применения теоретических основ транспортной энергетики для решения конкретных задач технического характера и навыки практического использования теплотехнических расчётов. В предлагаемых методических указаниях в первых разделах кратко приведены основные теоретические положения термодинамического метода анализа частных тепловых процессов, а также основы метода термодинамических циклов. Рассмотрены количественные характеристики циклов Карно, Отто, Дизеля и Тринклера, составляющих основу работы современных двигателей внутреннего сгорания. Варианты контрольных заданий (задание 1 и задание 2) выбираются студентом согласно номерам последней и предпоследней цифр номера зачетной книжки по таблицам 3.1 - 3.10. Условие заданий, конкретные исходные данные, результаты вычислений, выводы и ответы на вопросы оформляются в соответствии с принятыми в вузе нормами. Отчет по выполнению контрольной работы должен включать следующие составляющие: · титульный лист; · основной текст работы; · заключение; · библиографический список. Образец оформления титульного листа контрольной работы приведен в Приложении. Оформление текстадолжен быть единым для всей выполняемой работы. Работа выполняются на персональном компьютере, в текстовом редакторе WORD · формат страницы А4, параметры страницы 210 - 297мм; · поля страницы: верхнее - 20мм; нижнее - 20мм; левое – 30иммм; правое - 10мм; · шрифт - кегль 14, гарнитура «Таймс»; · межстрочный интервал - 1,5; · абзацный отступ - 1,25; · выравнивание - по ширине; · нумерация страниц располагается внизу по центру страницы.
ОСНОВНЫЕ ПОЛОЖЕНИЯ ТЕРМОДИНАМИКИ. ЧАСТНЫЕ ПРОЦЕССЫ Основные понятия и определения
Термодинамическая система - тело или совокупность тел, полностью характеризующихся некоторым набором значений макроскопических параметров. Термодинамические параметры - физические величины, характеризующие макроскопическое состояние тел. К ним относятся температура Т, давление р, объем V. Температура (t, 0С; Т, К) - термодинамический параметр характеризующий степень нагретости тел. Объем (V, м3), удельный объем ( v, м3/кг), молярный объем (v мол, м3/моль) - соответственно, объем всего тела, объем, приходящийся на единицу массы или на один моль вещества. Давление (р, Н/м2, Па) - термодинамический параметр, характеризующий суммарное импульсное воздействие частиц тела на ограничивающую его поверхность. Равновесное состояние системы - это, как правило, установившееся состояние системы, которое характеризуется определенным набором численных значений термодинамических параметров. Равновесное состояние системы характеризуется уравнением состояния j (р, Т, V) = 0. Уравнение состояния системы - функциональная связь между термодинамическими параметрами системы, находящейся в равновесии: р = j(Т, V); Т = f (р, V) или V = f(Т, р). Идеальный газ - газ, молекулы которого не обладают взаимным притяжением и взаимодействуют между собой соударяясь как абсолютно упругие тела. Реальные газы при сравнительно небольших избыточных давлениях (до 10¸105 Па) разрежены и близки по свойствам к идеальным. Уравнение состояния идеальных газов. В равновесных состояниях термодинамические параметры идеального газа взаимосвязаны уравнением, известным как уравнение Менделеева-Клапейрона (объединенный газовый закон):
где n - количество киломолей газа, М - масса газа (кг), μ - молярная масса газа (кг/кмоль), R - универсальная газовая постоянная, R = 8314 Дж/(кмоль·К). Внутренняя энергия системы (U, Дж) - совокупность всех видов энергии в веществах системы, которая является функцией состояния системы. Внутренняя энергия идеального газа зависит только лишь от температуры и обусловлена его кинетической энергией, которая для одного моля равна:
U = (3/2)RТ для одноатомных газов (1.1.2)
U = (5/2)RТ для двухатомных газов (1.1.3)
Равновесный термодинамический процесс - процесс воздействия на систему, при котором изменение состояний системы проходит через равновесные состояния, в которых термодинамические параметры взаимосвязаны уравнением состояния. Теплота процесса (Q, Дж) - количество энергии, переданной в процессе в микроскопической форме без заметных механических перемещений тел. Работа процесса (L, Дж) - количество энергии, переданной в процессе в макроскопической форме при заметных механических перемещениях тел. Первый закон термодинамики - закон сохранения энергии в процессах с участием теплоты. Теплота, подведенная к системе, расходуется на изменение ее внутренней энергии и совершение работы: Q =
d Q = dU + d L (в дифференциальной форме) (1.1.5)
Теплота и работа процесса зависят от пути его проведения и не являются функциями состояния системы.
|

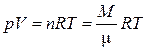 , (1.1.1)
, (1.1.1) U + L (в интегральной форме), (1.1.4)
U + L (в интегральной форме), (1.1.4)


