1. Возведение в степень и извлечения корня.
При возведении в степень числа, представленного в степенной форме, показатель его степени умножается на степень, в которую возводится число:
(1,2× 105)3 =1,23×105× 3 =1,7×1015;
При извлечении корня из числа, представленного в степенной форме, показатель его степени делится на показатель корня:
 .
.
Если показатель степени числа не делится на показатель корня без остатка, то подкоренное число следует преобразовать, например:

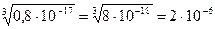
2. Логарифмическое представление численных величин.
Десятичным логарифмом по основанию 10 (сокращенно lg) называется показатель степени, в которую следует возвести 10, чтобы получить заданное число:
lgx =y.
Например, lg105=5, lg1=0, lg10-2 = -2.
Действие обратное логарифмированию называется антилогарифмированием:
x= 10y.
Например, lgx =2, следовательно, х=102=100.
2.1 Умножение и деление:
lgab= lga + lgb
lga/b =lga – lgb
Определяя логарифм числа, меньшего 1 или большего 10, нужно сначала записать это число в стандартном степенном представлении:
lg450 = lg(4,5×102) = lg4,5 + lg102 = 0,654 + 2 = 2,653
lg0,0673 =lg(6,73×10-2) = lg6,73 + lg 10-2 = 0,828 – 2= -1,172.
2.2 Возведение в степень и извлечение корня
lg an = n(lga)
lg a 1/n = 1/nlg a.
Натуральным логарифмом числа по основанию е (обозначается ln) называется показатель степени, в которую следует возвести число е = 2,71828…, чтобы получить заданное число. Между десятичным и натуральным логарифмом существует соотношение:
ln a = 2,303 lg a.
3. Квадратные уравнения вида ах 2 + вх + с = 0 имеют два решения: 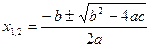
ОГЛАВЛЕНИЕ
|
| Стр.
|
| 1.Периодическая система химических элементов
|
|
| 2. Энергия ионизации и сродство к электрону
|
|
| 3. Относительная электроотрицательность
|
|
| 4. Зависимость орбитальных радиусов атомов от атомного номера элемента
|
|
| 5. Периодическая зависимость сродства к электрону и первой энергии ионизации атомов от атомного номера элемента
|
|
| 6. Сведения о некоторых элементарных частицах
|
|
| 7. Расположение валентных σ-электронных пар центрального атома А и пространственная конфигурация молекул АВn
| 8-9
|
| 8. Строение и электрические моменты диполей (μ) некоторых молекул
|
|
| 9. Длина и энергия химической связи
|
|
| 10. Параметры химической связи двухатомных молекул
|
|
| 11. Типы межмолекулярных взаимодействий
|
|
| 12. Вклад отдельных составляющих в полную энергию межмолекулярного взаимодействия
|
|
| 13. Термодинамические константы некоторых веществ
| 13-22
|
| 14. Константы диссоциации кислот в водных растворах
| 22-25
|
| 15. Константы диссоциации неорганических оснований в водных растворах
|
|
| 16. Константы нестойкости комплексных ионов
| 26-27
|
| 17. Диаграммы расщепления d-орбиталей в октеэдрическом и тетраэдрическом полях лигандов
|
|
| 18. Растворимость неорганических веществ в воде при комнатной температуре
|
|
| 19. Произведение растворимости труднорастворимых в воде соединений
| 29-30
|
| 20. Длины волн спектра и соответствующие им окраски
|
|
| 21. Стандартные потенциалы металлических электродов (Т=298К)
|
|
| 22. Стандартные электродные потенциалы в водных растворах
| 32-39
|
23. Перенапряжение водорода (  ) и кислорода ( ) и кислорода (  ) на различных электродах при плотности тока 1 А/см2, t=250С, в подкисленных растворах ) на различных электродах при плотности тока 1 А/см2, t=250С, в подкисленных растворах
| 29-40
|
| 24. Интервалы перехода окраски важнейших кислотно-основных индикаторов
|
|
| 25. Основные физические постоянные
|
|
| 26. Математические действия
| 41-42
|

 .
.
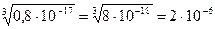
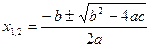
 ) и кислорода (
) и кислорода (  ) на различных электродах при плотности тока 1 А/см2, t=250С, в подкисленных растворах
) на различных электродах при плотности тока 1 А/см2, t=250С, в подкисленных растворах



