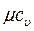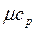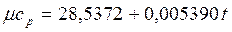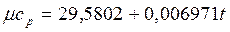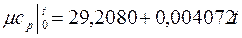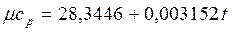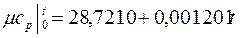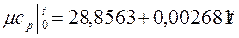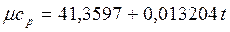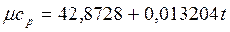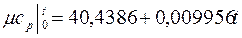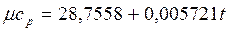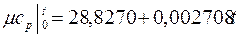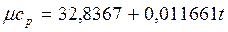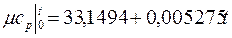Основные определения. Теплоемкостью тела называется количество теплоты, необходимое для повышения его температуры на 1 градус
Теплоемкостью тела называется количество теплоты, необходимое для повышения его температуры на 1 градус. Теплоемкость единицы количества вещества называется удельной теплоемкостью. Различают удельные теплоемкости: массовую – с, кДж/(кг∙К); объемную – С, кДж/(м3∙К); мольную –
В теплотехнике принято удельную теплоемкость называть просто теплоемкостью. Теплоемкость зависит от природы рабочего тела, его температуры и характера процесса, в котором происходит подвод или отвод теплоты. Теплоемкость газов с повышением температуры увеличивается. Если 1 кг газа нагревается от
Теплоемкость тела, соответствующая определенной температуре, называется истинной теплоемкостью. Зависимость истинной теплоемкости газа от температуры имеет вид:
где a, b, d – постоянные для каждого газа коэффициенты. Средняя теплоемкость в интервале температур
Для интервала температур
Если известны табличные значения средней теплоемкости
Особое значение в термодинамике имеют теплоемкости газа при постоянном давлении, т.е. в изобарном процессе –
Отношение теплоемкостей
где k – показатель адиабаты. Теплоемкость смеси идеальных газов: а) массовая теплоемкость смеси
б) объемная теплоемкость смеси
Теплоемкость рабочего тела в политропном процессе
где n – показатель политропы. Теплота нагревания газа
где М – число молей газа. Если не учитывать зависимость теплоемкости газов от температуры, то можно пользоваться табл. 2.
Таблица 2.
Интерполяционные формулы для расчета истинных и средних мольных теплоемкостей газов в интервале температур 0 – 1000 оС приведены в табл. 3
Таблица 3
|

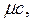 кДж/(моль∙К):
кДж/(моль∙К):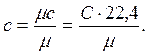 (5)
(5)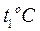 до
до 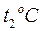 с подводом теплоты q, кДж, то средняя теплоемкость
с подводом теплоты q, кДж, то средняя теплоемкость  газа в рассматриваемом интервале температур
газа в рассматриваемом интервале температур  определяется по формуле
определяется по формуле .
.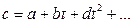
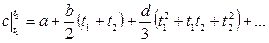
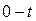

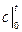 , то средняя теплоемкость в интервале
, то средняя теплоемкость в интервале 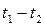
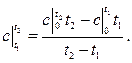 (6)
(6)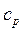 и при постоянном объеме, т.е. в изохорном процессе –
и при постоянном объеме, т.е. в изохорном процессе – 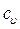 . Эти теплоемкости связываются формулой Майера
. Эти теплоемкости связываются формулой Майера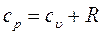 . (7)
. (7)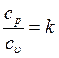 , (8)
, (8)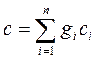 (9)
(9)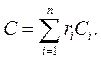 (10)
(10)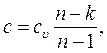 (11)
(11)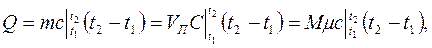 (12)
(12)