Механизм катализа
В настоящее время механизм катализа неизвестен. Действие катализатора традиционно объясняют образованием в его присутствии цепной реакции и соответствующим понижением энергии активации на первом звене цепи, определяющем начало реакции. Как это происходит? Почему, как бы участвуя в реакции, катализатор остается целым, не расходуется? Какие вещества могут быть катализаторами, а какие нет, и – почему? Эти и другие вопросы пока остаются без ответа. Как теперь известно /3/, молекулы вещества взаимодействуют друг с другом организованно электродинамически, перемещаясь каждая внутри своей глобулы, размер которой примерно на три порядка больше размера самой молекулы. Молекула совершает колебательные и вращательные движения, взаимодействуя поочередно с каждым из 12-ти окружающих ее соседей. При этом одновременно молекула взаимодействует только с одним соседом. Для газообразного вещества – это ближний, первый, ряд соседей; в жидком и твердом веществе имеет место дальнодействие, которое удерживает молекулу в пределах глобулы, а глобулу в пределах кристаллической решетки. Это электродинамическое взаимодействие, которое подробно расписано в /3/, обеспечивает взаимное притяжение молекул за счет их разноименных электрических полей. Обмен импульсами двух одинаковых молекул газа в одном акте взаимодействия приводит к их разлету с некоторой скоростью для совершения ими таких же актов взаимодействия с другими своими соседями. То же самое происходит при встрече молекулы газообразного или жидкого рабочего вещества с твердым веществом катализатора. А именно, в акте взаимодействия молекулы рабочего вещества с молекулой катализатора на первую действуют силы притяжения между ними, а также, вследствие дальнодействия, еще и силы от других молекул катализатора, что существенно увеличивает динамический разгон рабочей молекулы по направлению к катализатору. Более того, в отличие от молекулы газа, молекула твердого вещества не вращается, а только колеблется. Поэтому летящая (в пределах своей глобулы) к катализатору молекула газа не встречает отталкивания противоположно заряженных полей. Электрическое поле стабилизирует полет молекулы газа по направлению к мишени-катализатору: молекула газа, как и в любом акте электродинамического взаимодействия, прекращает свое вращение и, в данном случае, летит по наикратчайшему пути. Все это способствует ее ускоренному полету к мишени, усилению ударных нагрузок при встрече с ней и – разрушению самой молекулы. При этом, как было сказано выше, остальные соседи-молекулы рабочего вещества не мешают, не препятствуют разгону молекулы, так как заняты своими личными делами – актами взаимодействия с другими своими соседями. Сила притяжения увеличивается обратно пропорционально квадрату расстояния и пропорционально произведению разноименных зарядов, взаимодействующих тел /3/. Если учесть, что нормальная скорость движения молекул, например, воздуха, при их взаимодействии имеет порядок 104 м/с, то при сближении с катализатором она многократно и резко увеличивается, что приводит к удару и мгновенному гашению скорости. Это в высшей степени ярко выраженная нелинейность очень похожа на график изменения энергии, например, кавитационного пузырька в жидкости. В обоих случаях энергия, пропорциональная квадрату скорости, как бы накачивается постепенно, а затем внезапно разом высвобождается, что, в соответствии с третьим законом Исаака Ньютона (Действие равно противодействию – третий закон Ньютона. При этом Ньютон поясняет, что действие – это произведение силы действия на скорость действия, а противодействие – это произведение силы реакции на скорость реакции. Поэтому третий закон имеет вид Естественно, что рекомбинация атомов, и тем более нуклонов, в продукты реакции в присутствии катализатора имеет меньший активационный барьер, чем рекомбинация молекул, что не только обеспечивает реакцию, которая без катализатора вообще не идет, и ускоряет ее, но и исключает повышенную энергетическую напряженность в зоне реакции. Так, известно, что соединение водорода с кислородом на платине происходит при обычной комнатной температуре, без пламени свечения. Как видно, механизм катализа, в конечном счете, заключается в разрушении молекул рабочего вещества и взаимодействии их более мелких частей: атомов, осколков и даже нуклонов для образования продуктов реакции. Никакой цепной реакции здесь не просматривается. Также видно, что катализатор при этом не расходуется, так как не разрушается (если бы разрушался и расходовался, то это уже был бы не катализатор). Теперь, разобравшись с механизмом катализа, можем предъявить требования к катализатору и четко определить химические элементы, которые им могут быть. Итак, молекулы катализатора должны быть более прочными, чем молекулы всех остальных веществ. Поскольку избыточный заряд молекул газов и некоторых других рабочих веществ, как правило, положительный, то избыточный заряд катализатора должен быть противоположным – отрицательным для усиления притяжения. Молекулы катализатора должны быть соединены (электрическими силами) в единую массивную систему (кристаллическую решетку) для уменьшения отдачи при ударе и увеличения силы, разгоняющей и разрушающей молекулу рабочего вещества. Не так уж и много требований к катализатору: прочность, заряд, массивность. Легкие и структурно непрочные молекулы не могут служить катализатором, так как не обеспечат разрушения молекул рабочего вещества и сами могут разрушиться, демпфировать удар, вступить в реакцию и выбыть из игры. Наиболее прочной геометрической формой тел является сфера (шар). Она также соответствует природному принципу минимума поверхностной энергии, как в каплях воды – наименьшей энергии поверхностного натяжения. Этот принцип характерен также – для атомов вещества. Зная площадь сферы
Вторая сфера, охватывающая первую, состоит из Третья сфера, охватывающая вторую, состоит из 1) сфере из 12-ти нуклонов и атомной массе 12 а.е.м. соответствует углерод 2) сфере из 3) двум первым вложенным одна в другую сферам 4) трем вложенным одна в другую сферам соответствует больше гафний 5) отдельно третьей сфере 6) поскольку масса вложенных четырех сфер из нуклонов выходит за рамки периодической системы, то остается сама четвертая сфера с Итак, из довольно простой по разрешению, но сложной для понимания в рамках традиционной физико-химии, посылки мы получили сразу перечень катализаторов и теперь знаем, как они действуют. Большинство катализаторов являются металлами. Это соответствует требованию избыточности отрицательного заряда в них. Углерод, хотя и не является металлом, но совокупность его положительно заряженных атомов образует систему, скрепленную отрицательно заряженными электронами и имеющую в целом избыточный отрицательный заряд. Эта массивная система также соответствует всем требованиям, предъявляемым к катализаторам. То есть углерод также может быть катализатором при соответствующих условиях, например: осаждение на металлических поверхностях в силу противоположного заряда и образование массивной цепной системы совокупности атомов углерода. С пониманием механизма катализа также становится понятным принцип упрочения поверхности нанесением, например, углерода, платины…, имеющих прочные сферические, соединенные электрическими силами молекулы. Сферическую структуру могут иметь молекулы инертных газов, так как в них нет свободных электронов (связи), а структурные электроны в нуклонах атома связаны, заняты конструкцией; их заряды компенсированы противоположными, поэтому избыточный заряд мал и близок к нулю – именно отсюда их инертность. В отличие от металлов молекулы газов бешено вращаются, поэтому они не могут иметь точно сферическую форму, а имеют – сфероидную, поверхность которой меньше сферической и, соответственно, меньше нуклонов в атоме по сравнению со сферическими. Интересно, что величина уменьшения числа нуклонов как отношение их в ближайшей по размеру сфере к их числу в сфероиде для большинства инертных газов примерно одинакова: – для аргона – для криптона – для ксенона – для радона – и только для неона Выпадение неона из общего порядка показывает, что наряду с VIII группой есть еще IV-я группа периодической системы элементов, куда уже попали углерод и гафний как возможные катализаторы. Для других элементов IV группы: Итак, новые представления о строении вещества позволяют впервые понять механизм катализа и связанные с этим различные аспекты науки и техники, в том числе, условия подбора и работы катализаторов, физический смысл упрочнения материалов углеродом и другими веществами, структуру и характеристики инертных газов и т.д. В состав возможных катализаторов, как видно, входят металлы VIII группы и (некоторые) элементы IV группы периодической системы, имеющие сферическую форму атомов. То есть разбивка веществ по группам и периодам отражает не только нарастание массы атомов и изменение известных свойств, но и – регулярность изменения и периодичность повторения структуры (формы) атомов, в том числе, сферической, существенно влияющей и во многом определяющей свойства элементов.
|

 . Очевидно, что малая скорость реакции (скорость звука) вызывает большую силу реакции за счет большой скорости действия, способную разрушить молекулу вещества. (Русский перевод труда И.Ньютона "Математические начала натуральной философии", 1915 г., с.52; выполнен А.Н.Крыловым) приводит к возникновению больших сил, разрушающих молекулу рабочего вещества не только на атомы, но даже, возможно, на нуклоны, из которых атомы состоят, так как энергия связи нуклонов в атоме примерно на 14 порядков меньше энергии связи элементарных частиц в нуклоне / 3 /.
. Очевидно, что малая скорость реакции (скорость звука) вызывает большую силу реакции за счет большой скорости действия, способную разрушить молекулу вещества. (Русский перевод труда И.Ньютона "Математические начала натуральной философии", 1915 г., с.52; выполнен А.Н.Крыловым) приводит к возникновению больших сил, разрушающих молекулу рабочего вещества не только на атомы, но даже, возможно, на нуклоны, из которых атомы состоят, так как энергия связи нуклонов в атоме примерно на 14 порядков меньше энергии связи элементарных частиц в нуклоне / 3 /.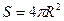 и расчетный диаметр нуклонов
и расчетный диаметр нуклонов  , из которых она образована, можем найти их количество и, соответственно, атомную массу и само вещество катализатора. Известно, что самая малая сфера (
, из которых она образована, можем найти их количество и, соответственно, атомную массу и само вещество катализатора. Известно, что самая малая сфера ( ) содержит 12 шаров (нуклонов):
) содержит 12 шаров (нуклонов): .
. нуклонов.
нуклонов. нуклонов. И четвертая сфера – из
нуклонов. И четвертая сфера – из  нуклонов. Согласно периодической системе элементов и полученному результату катализаторами могут быть следующие вещества:
нуклонов. Согласно периодической системе элементов и полученному результату катализаторами могут быть следующие вещества: ;
; соответствует титан
соответствует титан  ;
;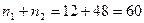 соответствует кобальт
соответствует кобальт  , а также, в меньшей мере, железо
, а также, в меньшей мере, железо  и медь
и медь  ;
; ;
;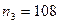 соответствует палладий
соответствует палладий  ;
;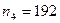 нуклонами. Ей соответствуют осмий
нуклонами. Ей соответствуют осмий  , а также – иридий
, а также – иридий  и платина
и платина  .
.
 ;
;
 ;
;
 ;
;
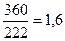 (360 нуклонов – в 4-х сферах);
(360 нуклонов – в 4-х сферах);
 – эта величина больше остальных.
– эта величина больше остальных. ,
, 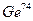 ,
,  – количество нуклонов в их сферическом атоме определяется аналогично описанному выше при
– количество нуклонов в их сферическом атоме определяется аналогично описанному выше при  .
.


