Баланс продуктов азотной реакции
Как известно, объемные доли азота и кислорода в воздухе составляют, соответственно, 0,79 и 0,21. Зная плотности азота
Относительное число молекул азота (к молекулам кислорода) найдем из уравнения баланса массы
Относительное число молекул кислорода (к сумме молекул азота и кислорода в воздухе) – по определению Зная механизм распада азота, можем сделать расчет и составить баланс продуктов азотной реакции. При этом будем иметь в виду, что распаду подвергаются все без исключения молекулы азота, и весь водород переходит в воду. В свою очередь, образование воды идет своим известным цепным механизмом /9/. Звенья цепочки реакций имеют меньший активационный барьер, чем прямая реакция (3), что снижает затраты энергии на возбуждение реакции. Особенностью цепной реакции является ее разветвление на реакцию, ведущую к образованию воды Для расчета количества кислорода-замедлителя, оставшегося в продуктах азотной реакции, представим объем зоны реакции в виде куба с ребром, условно вмещающим 10 молекул воздуха. Тогда количество молекул в объеме куба будет, соответственно,
Количество молекул оставшегося неиспользованным кислорода-замедлителя на границах зоны реакции с учетом равной вероятности (
или Уравнение баланса продуктов азотной реакции (на одну молекулу кислорода воздуха) в общем виде можем записать так:
Коэффициенты в (5) определим следующим образом. Целое число молекул
Коэффициент
Теперь уравнение баланса азотной реакции при принятых условиях будет иметь вид:
Массовые доли продуктов реакции: – водяной пар (вода) – углерод (графит) – кислород (замедлитель) – водород (в составе воды) Коэффициенты и параметры могут меняться от условий проведения азотной реакции.
|

 , кислорода
, кислорода  и воздуха
и воздуха  (при нормальных условиях: 0ºС и 760 мм рт. ст.), найдем массовые доли азота и кислорода
(при нормальных условиях: 0ºС и 760 мм рт. ст.), найдем массовые доли азота и кислорода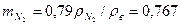 ;
; .
. , откуда
, откуда .
. (совпадает с объемной долей).
(совпадает с объемной долей). , и – реакцию, ведущую к образованию малоактивного радикала
, и – реакцию, ведущую к образованию малоактивного радикала  , прерывающего цепочку реакций, особенно на холодных границах зоны реакции. То есть, если азот является ускорителем реакции, то кислород, как видно, является замедлителем реакции и поэтому должен частично остаться в продуктах реакции.
, прерывающего цепочку реакций, особенно на холодных границах зоны реакции. То есть, если азот является ускорителем реакции, то кислород, как видно, является замедлителем реакции и поэтому должен частично остаться в продуктах реакции. , а на границах куба
, а на границах куба  . С учетом соотношения молекул кислорода и азота в воздухе количество молекул кислорода на границах зоны реакции будет
. С учетом соотношения молекул кислорода и азота в воздухе количество молекул кислорода на границах зоны реакции будет .
. ) разветвления реакции (на ее продолжение и прерывание) будет:
) разветвления реакции (на ее продолжение и прерывание) будет:
 молекулы О2 на каждую молекулу О2 в воздухе.
молекулы О2 на каждую молекулу О2 в воздухе. (5).
(5). (на одну молекулу
(на одну молекулу  ):
): .
. (как остальное
(как остальное  )
)
 (6).
(6). ;
; ;
; ;
; .
.


