ЕЛЕКТРОЛІЗ
Електролізом називають сукупність окислювально-відновних реакцій, що перебігають на електродах під час проходження через них постійного електричного струму від зовнішнього джерела енергії. Іноді електроліз спрощено характеризують як розклад речовини під дією електричного струму. При електролізі на негативному електроді (катоді) відбувається розряд катіонів, на позитивному (аноді) – розряд аніонів або окиснення матеріалу анода. У разі можливості перетворення на електродах декількох речовин на катоді першочергово перебігає процес, який характеризується найбільшим значенням електродного потенціалу серед конкуруючих реакцій відновлення, а на аноді – процес з найменшим значенням потенціалу серед можливих реакцій окиснення. За першим законом Фарадея маса речовини, що перетворюється при електролізі, прямо пропорційна кількості електрики, яку пропущено через систему:
де За другим законом Фарадея внаслідок проходження однакової кількості електрики через різні електролітні системи маси речовин, що перетворюються на електродах, відносяться між собою як молярні маси їх еквівалентів або просто як хімічні еквіваленти. Звідки випливає, що:
де Хімічний еквівалент речовини залежить від того, який саме електрохімічний процес перебігає на катоді або аноді. Для обчислення цієї величини записують електродну реакцію і визначають відношення молярної (атомної) маси речовини, що перетворюється на електроді, до кількості електронів, які беруть участь в електродному процесі
Із другого закону Фарадея випливає, що на перетворення одного моль-еквівалента будь-якої речовини витрачається однакова кількість електрики, яка називається сталою Фарадея ( За законами Фарадея масу речовини, що зазнає електрохімічних змін при електролізі на катоді або аноді, розраховують за рівнянням:
Швидкість електролізу залежить від густини електричного струму, яку визначають за формулою:
де Важливою кількісною характеристикою ефективності електролізу є вихід за струмом
або
Якщо вихід за струмом менший за 100 %, то причинами цього можуть бути з одного боку перебіг побічних (паралельних, спряжених, конкуруючих) процесів, що відбуваються одночасно з основною реакцією на тому самому електроді, а з іншого – наявність вторинних процесів, внаслідок яких кількість перетвореної при електролізі речовини у системі зменшується (відбувається її взаємодія з компонентами розчину, з матеріалом електрода, електрохімічна зміна на протилежному електроді тощо).
|

 , (6.1)
, (6.1)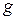 – маса перетвореної внаслідок електролізу речовини;
– маса перетвореної внаслідок електролізу речовини;  – коефіцієнт пропорційності (електрохімічний еквівалент), який чисельно дорівнює масі речовини, що зазнала перетворення в процесі електролізу в результаті проходження через систему 1 кулона (1 Кл = 1 А×с) електрики;
– коефіцієнт пропорційності (електрохімічний еквівалент), який чисельно дорівнює масі речовини, що зазнала перетворення в процесі електролізу в результаті проходження через систему 1 кулона (1 Кл = 1 А×с) електрики;  – кількість пропущеної через електрохімічну систему електрики (Кл);
– кількість пропущеної через електрохімічну систему електрики (Кл);  – сила струму (А);
– сила струму (А);  – тривалість електролізу (с).
– тривалість електролізу (с). ,
, – хімічний еквівалент речовини і (г/моль-екв.)
– хімічний еквівалент речовини і (г/моль-екв.)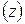 :
: .
. ):
): 
 . (6.2)
. (6.2) , (6.3)
, (6.3) – площа поверхні електрода (м2 або см2).
– площа поверхні електрода (м2 або см2). . Його виражають у відсотках і визначають або за практично отриманою та теоретично розрахованою за рівнянням (6.2) масами перетвореної речовини, або за її практично виміряним та теоретично обчисленим об’ємами, що приведені до нормальних умов:
. Його виражають у відсотках і визначають або за практично отриманою та теоретично розрахованою за рівнянням (6.2) масами перетвореної речовини, або за її практично виміряним та теоретично обчисленим об’ємами, що приведені до нормальних умов: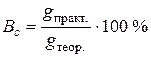 (6.4)
(6.4) . (6.5)
. (6.5)


