Скорость химических реакций. Химическое равновесие
Auditing is a very ancient activity. «Audit» is a Latin word that means «he hears*. In ancient times auditing was the process whereby the owner heard the account given by his steward of the use of the owner’s resources. The origin of stewardship goes back into the Middle Ages. It was the original purpose of accounting and was also called «accountability». Kings or lords who were away at war or for other purpose usually left their estates in the hands of the steward. The steward kept an account of the payments and receipts of the estate so that he could be discharged of responsibility when the owner returned. As a rule, the steward used to tender an account to the owner, who might be illiterate and had to hear it («audit» — «he hears»). Auditing is an accounting function that involves the review and evaluation of financial records. It is done by someone other than the person who entered the transactions in the records. This work can be done both by internal auditors and outside ones. Many companies employ their own accountants, to maintain an internal audit. They continuously review operating procedures and financial records and report to management on the current state of the company’s fiscal affairs. They check the accounting records in regard to completeness and accuracy, making sure that all irregularities are corrected. Overall, the internal auditors seek to ensure that the various departments of the company follow the policies and procedures established by management. Currently, outside auditing is a normal and regular part of business-practice. Independent auditing is done by accountants who are not employees of the organization whose books they examine. The independent accountant is a highly qualified specialist. He or she review the business operating activities, examine financial statements, the accounting records, and supporting business papers usually known as evidential matter. It is performed in order to determine the accuracy, authenticity and completeness of the records. The accountant’s judgment or opinion on the fairness of the records is contained in a document sent to the client upon completion of the audit. There are 4 major companies that compete in the financial audits arena. They form what is known as the Big Four. These companies are international forms and are the most well known outside auditors in the industry. They are as follows in order of size: 1. PricewaterhouseCoopers, also known as PwC; 2. KPMG, used to be known as Klienveld Peat Marwick Gordeler; 3. DeloitteTouche Tohmatsu, also known as Deloitte; 4. Ernst & Young, also known as E & Y. There are many other audit firms competing with big four. In the C, n ^ '• - * • ' -«• r~m, t rf I US, mid-tier firms such as Grant Thorton and Moss Adams serve many mid-size companies while smaller entities may contract the services of local CPA firms. In the UK the medium sized firms are also referred to as mid-tier. Many of these firms are international and increasingly are competing for work against the big four. Answer the following questions: 1. How can you define auditing? 2. What is the origin of the word «audit»? 3. Who is usually auditing done by? 4. What is the aim of internal auditors? 5. What are the duties of independent accountants? 6. What are the most famous companies that compete in the financial audits arena?.. Translate the following sentences with modal verbs into Ukrainian: 1. You may use this information if you want. 2. This company may have asked our bank for a loan. 3. We could get all the information concerning this company last time. 4. He could have verified these accounts. 5. Suppliers of goods must be sure that these goods will be paid for. 6. This company must have designed its own chart of accounts. 7. Any business should be regarded as an economic entity. 8. You should not have opened an account with this bank.
Скорость химических реакций. Химическое равновесие Скорость химической реакции количественно характеризуется изменением концентраций реагирующих веществ в единицу времени. Скорость химической реакции зависит от природы реагирующих веществ и условий протекания реакции: концентрации, температуры, присутствия катализатора, а также от некоторых других факторов. Основной закон кинетики устанавливает зависимость скорости гомогенной (однофазной) химической реакции от концентрации реагирующих веществ: скорость химической реакции пропорциональна произведению концентраций реагирующих веществ в степенях, соответствующих стехиометрическим коэффициентам в уравнении реакции. Так, для реакции m A + n B = p C + q D
где СА и СВ – концентрации веществ А и В, моль/л; k – константа скорости. Она численно равна скорости реакции при условии, если концентрации каждого из реагирующих веществ составляют Если в гомогенных системах химическое взаимодействие происходит во всем объеме, то в гетерогенных (многофазных) системах лишь на поверхности твердой фазы, которая остается также неизменной. При этом концентрация твердого участка реакции также не изменяется. Так, для реакции горения угля Ств + О2 газ = СО2 газ закон действующих масс может быть записан следующим образом:
где k – константа скорости; Sc – величина поверхности угля; Обозначая произведение постоянных величин
т.е. скорость гетерогенной химической реакции пропорциональна лишь концентрации газообразного реагента (кислорода), концентрация и площадь поверхности твердого вещества (угля) входит в значение константы скорости. Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа: при повышении температуры на каждые 10 ° С скорость реакции увеличивается в 2-4 раза:
где Правило Вант-Гоффа является приближенным и применимо лишь для ориентировочной оценки влияния температуры на скорость реакции. Большинство химических реакций являются обратимыми. Они заканчиваются достижением состояния химического равновесия. В состоянии равновесия прямая и обратная реакции не прекращаются, поэтому такое равновесие называют подвижным, или динамическим. Концентрация всех веществ, которые устанавливаются при химическом равновесии, называются равновесными. В состоянии равновесия скорости прямой и обратной реакций равны между собой. Так, для обратимого процесса
при установившемся равновесии
откуда
где Выражение (5) носит название закона действия масс: отношение произведения равновесных концентраций продуктов к произведению равновесных концентраций исходных веществ в степенях, равных стехиометрическим коэффициентам в уравнении реакции, есть величина постоянная при данной температуре. Константа равновесия не зависит от концентрации, а изменяется лишь с изменением температуры. Если константа равновесия выражена через концентрации реагирующих веществ, то ее принято обозначать Например, для реакции

Если обратимая реакция является гетерогенной, то химическое равновесие должно устанавливаться на всех границах раздела между всеми фазами. Если в гетерогенной реакции участвуют твердые вещества и газы, например реакция горения угля, то в выражение для константы химического равновесия входят лишь парциальные давления газообразных участков реакции:
Направление смещения химического равновесия определяется общим положением, известным под названием принципа Ле Шателье: изменение одного из условий (температуры, концентрации, давления), при которых система находится в состоянии равновесия, вызывает смещение равновесия в направлении той реакции, которая противодействует произведенному изменению. Согласно принципу Ле Шателье при повышении температуры происходит смещение равновесия в сторону эндотермической реакции, при понижении – в сторону экзотермической. Увеличение концентрации исходных веществ смещает равновесие в сторону образования продуктов: увеличение концентрации продуктов реакции смещает равновесие в сторону образования исходных веществ. Изменение давления действует на смещение равновесия реакций, идущих с изменением числа молей газообразных веществ. Увеличение давления смещает равновесие в сторону реакции, приводящей к уменьшению числа молей в газовой фазе, а следовательно, к уменьшению давления в системе. 2. Спецификация теста по теме Для контроля знаний по данной теме предлагаются тестовые задания, включающие понятия скорости химической реакции, факторы, влияющие на нее, математическое выражение для скорости гомогенной и гетерогенной реакций, зависимость скорости реакции от температуры (правило Вант-Гоффа), представления о химическом равновесии, математическое выражение закона действующих масс (константы равновесия), способы смещения химического равновесия (принцип Ле Шателье).
Перечень объектов контроля: а) фактологические знания – знание основных научно-технических терминов, фактов и процессов; б) базовые знания – знание основных понятий и законов; в) методологические знания и умения – знать и уметь использовать методы теоретического и экспериментального исследования в химии, уметь оценивать численные порядки величин при расчетах Используется закрытая форма заданий с выборочными ответами. Всего 15 вариантов теста, число заданий 5, к каждому заданию даны несколько ответов, из которых только один правильный. Общее время выполнения теста 45 минут. За каждое правильно выполненное задание начисляется 2 балла. Максимальная сумма баллов 10. Предлагается следующая категория пересчета по пятибалльной системе 9-10 – 5; 7-8 – 4; 5-6 – 3.
Варианты теста Вариант 1
А 1. Скорость реакции уменьшается при понижении температуры с 35°С до 15 °С при
1) 2,5 раза 2) 20 раз 3) 2,520 раз 4) 50 раз 5) 6,25 раза
А 2. Повышение температуры в системе
1) уменьшению концентрации 2) увеличению концентрации 3) увеличению концентрации 4) уменьшению концентрации 5) смещению равновесия вправо (→)
А 3. Скорость прямой реакции
при увеличении давления смеси в 4 раза изменится
1) уменьшится в 4 раза 2) увеличится в 4 раза 3) увеличится в 16 раз 4) правильного ответа нет 5) уменьшится в 16 раз
А 4. Константа равновесия реакции
соответствует выражению
1) 4)
А 5. В состоянии равновесия в реакции
концентрации равны Исходная концентрация О2 (моль/л) равна
1) 4 2) 5 3) 4) 12 5) 12,2
Вариант 2 А 1. При повышении температуры от 90 ° С до 130 ° С при
1) 3 раза 2) 9 раз 3) 27 раз 4) 12 раз 5) 81 раз
А 2. Понижение давления в системе
1) увеличению концентрации 2) уменьшению концентрации 3) увеличению концентрации паров 4) уменьшению концентрации паров 5) сохранению концентрации паров
А 3. Реакция идет по уравнению А(газ) + 2В(газ) → С(газ) Скорость реакции при концентрации для вещества А
1) 0,2 2) 0,3 3) 0,4 4) 0,5 5) 0,6
А 4. Константа равновесия реакции
соответствует выражению
1) 4)
А 5. В состоянии равновесия в реакции
1) 2,5 2) 8,5 3) 3,5 4) 10,5 5) 12 Вариант 3
А 1. При 353 К реакция заканчивается за 20 секунд. Температурный коэффициент скорости реакции времени протекания реакции при 323 К равен
1) 2,5 с 2) 8 с 3) 40 с 4) 160 с 5) 240 с
А 2. Повышение давления в системе
1) увеличению концентрации 2) увеличению концентрации 3) останется концентрация 4) останется концентрация 5) смещению равновесия в сторону обратной реакции
А 3. Скорость прямой реакции
1) увеличится в 6 раз 2) увеличится в 22 раза 3) увеличится в120 раз 4) увеличится в 2592 раза 5) увеличится в 113 раз
А 4. Константа равновесия реакции
1) 4)
А 5. В гомогенной реакции
1) 0,09 2) 0,11 3) 0,3 4) 2,25 5) 2,7 Вариант 4 А 1. Для увеличения скорости реакции в 16 раз при
1) 20°С 2) 30°С 3) 40°С 4) 50°С 5) 60°С
А 2. Реакция, в которой повышение давления и повышение температуры вызовут смещение равновесия в одну сторону, это
А 3. Скорость обратной гомогенной реакции
1) уменьшится в 80 раз 2) уменьшится в 2 раза 3) уменьшится в 576 раз 4) уменьшится в 210 раз 5) увеличится в 4 раза
А 4. Математическое выражение скорости прямой реакции
1) 4)
А 5. В гомогенной газообразной реакции
начальная концентрация хлорида фосфора (
1) 0,0125 2) 0,05 3) 0,25 4) 0,8 5) 0,75 Вариант 5
А 1. При повышении температуры на 20 ° С при
1) 4 раза 2) 80 раз 3) 16 раз 4) 8 раз 5) 204 раз
А 2. В гомогенной реакции
1) увеличению концентрации 2) увеличению концентрации 3) уменьшению концентрации 4) увеличению концентрации 5) уменьшению концентрации
А 3. Скорость прямой реакции
1) увеличится в 4 раза 2) не изменится 3) уменьшится в 4 раза 4) увеличится в 2 раза 5) уменьшится в 2 раза
А 4. Константа равновесия реакции
1) 4)
А 5. В гомогенной газообразной реакции
1) 6 2) 12 3) 5 4) 10 5) 14
Вариант 6
А 1. При повышении температуры с 30°С до 60°С скорость реакции увеличится в
1) 1,5 раза 2) 150 раз 3) 6 раз 4) 9 раз 5)
А 2. Повышение давления в системе
1) увеличению концентрации 2) увеличению концентрации 3) смещению равновесия влево (←); 4) сохранению равновесия системы; 5) смещению равновесия вправо (→).
А 3. Скорость прямой реакции
1) 4 раза 2) 24 раза 3) 48 раз 4) 128 раз 5) 144 раза
А 4. Константа равновесия реакции
1) 4)
1) 0,01 2) 0,02 3) 0,03 4) 0,04 5) 0,05 Вариант 7
А 1. При повышении температуры на 40°С скорость реакции увеличилась в 256 раз. Температурный коэффициент скорости реакции (
1) 2 2) 4 3) 6 4) 8 5) 16
А 2. Реакция, в которой повышение давления и понижение температуры вызовут смещение равновесия в одну сторону это
А 3. Скорость реакции
1) уменьшится в 4 раза 2) увеличится в 4 раза 3) не изменится 4) увеличится в 16 раз 5) уменьшится в 16 раз
А 4. Математическое выражение скорости прямой реакции
1) 4)
А 5. В гомогенной газообразной реакции
1) 10 2) 3) 7,7 4) 9 5) 11 Вариант 8
А 1. Скорость реакции уменьшится при понижении температуры от 120°С до 80°С при
1) 24 раза 2) 81 раз 3) 12 раз 4) 64 раза 5) 120 раз
А 2. Повышение температуры в системе
1) увеличению концентрации 2) увеличению концентрации 3) смещению равновесия влево (←); 4) уменьшению концентрации 5) сохранению концентрации
А 3. Скорость прямой реакции
при изменении концентрации
1) увеличится в 32 раза 2) увеличится в 36 раз 3) увеличится в 10 раз 4) увеличится в 8 раз 5) увеличится в 3 раза
А 4. константа равновесия реакции
1) 4)
А 5. В состоянии равновесия в реакции
1) 8 2) 17 3) 1 4) 29 5) 49
Вариант 9 А 1. При понижении температуры с 60 ° С до 40 ° С скорость реакции уменьшилась в 4 раза. Температурный коэффициент (
1) 42 2) 0,2 3) 4 4) 80 5) 2
А 2. Понижение давления в системе
1) увеличению концентрации 2) уменьшению концентрации 3) сохранению концентрации 4) смещению равновесия вправо (→) 5) смещению равновесия влево (←)
А 3. При увеличении давления в 4 раза в реакции
1) уменьшится в 4 раза 2) увеличится в 4 раза 3) увеличится в 16 раза 4) правильного ответа нет 5) уменьшится в 16 раз
А 4. Константа равновесия реакции
1) 4)
А 5. В состоянии равновесия в реакции
1) 7 2) 11 3) 15,5 4) 5) 9
Вариант 10 А 1. При понижении температуры на 30 ° С и температурном коэффициенте
1) 81 раз 2) 4 раза 3) 12 раз 4) 64 раза 5) 120 раз
А 2. Равновесие реакции
1) понижении давления 2) повышении концентрации CO 3) повышении температуры 4) дополнительное введение 5) понижении температуры
А 3. Скорость прямой реакции
1) уменьшится в 3 раза 2) уменьшится в 6 раз 3) не изменится 4) уменьшится в 9 раз 5) правильного ответа нет
А 4. Константа равновесия реакции
1) 4) А 5. В состоянии равновесия в гомогенной реакции
1) 4 2) 5 3) 13 4) 15 5) 17
Вариант 11 А 1. При повышении температуры на 100 ° С и температурном коэффициенте
1) 20 раз 2) 1000 раз 3) 40 раз 4) 210 раз 5) 200 раз
А 2. Равновесие гомогенной реакции
1) повышении температуры 2) повышении концентрации CO2 3) повышении давления 4) понижении концентрации O2 5) понижении давления
А 3. В системе
1) 100 раз 2) 18 раз 3) 12 раз 4) 36 раз 5) 6 раз
А 4. Константа равновесия реакции
1) 4)
А 5. В состоянии равновесия в гомогенной реакции
1) 18 2) 19,25 3) 12 4) 11,25 5) 13 Вариант 12 А 1. При повышении температуры от 180 ° С до 200 ° Си температурном коэффициенте
1) 6 2) 9 3) 320 4) 8 5) 81
А 2. Равновесие гомогенной реакции
1) повышении температуры 2) увеличении концентрации 3) увеличении концентрации
|

 ,
, , (1)
, (1) через
через  , получим:
, получим: , (2)
, (2)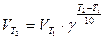 , (3)
, (3) и
и  – скорости реакции при конечной (Т2) и начальной (Т1) температурах, а
– скорости реакции при конечной (Т2) и начальной (Т1) температурах, а  – температурный коэффициент скорости реакции.
– температурный коэффициент скорости реакции. mA + nB pC + qD
mA + nB pC + qD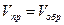 , или согласно основному кинетическому закону
, или согласно основному кинетическому закону , (4)
, (4)
 ,
, 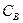 ,
,  и
и  – равновесные концентрации участников реакции;
– равновесные концентрации участников реакции;  и
и  – константы скоростей прямой и обратной реакций;
– константы скоростей прямой и обратной реакций;  – константа химического равновесия.
– константа химического равновесия.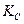 . Для реакций, протекающих с участием газообразных веществ, константу равновесия выражают через парциальные давления и обозначают
. Для реакций, протекающих с участием газообразных веществ, константу равновесия выражают через парциальные давления и обозначают 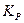 .
.






 в
в

 приведет к
приведет к








 2)
2)  3)
3) 
 5)
5) 



 моль/л и
моль/л и  8 моль/л.
8 моль/л. 3 скорость реакции увеличится в
3 скорость реакции увеличится в





 2)
2)  3)
3) 
 5)
5) 


 концентрации равны
концентрации равны  6 моль/л,
6 моль/л,  3 моль/л. Исходная концентрация
3 моль/л. Исходная концентрация 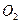 (моль/л) равна
(моль/л) равна

 приведет к
приведет к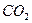



 2)
2)  3)
3) 
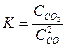 5)
5) 


 равновесные концентрации составляют
равновесные концентрации составляют  . Начальная концентрация азота (моль/л) равна
. Начальная концентрация азота (моль/л) равна температуру следует повысить на
температуру следует повысить на 1)
1) 

 2)
2) 
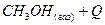
 3)
3) 
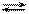 4)
4) 
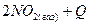
 5)
5) 



 при увеличении объема смеси в 2 раза изменится
при увеличении объема смеси в 2 раза изменится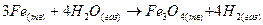 имеет вид
имеет вид 2)
2)  3)
3) 
 5)
5) 



 ) составляет
) составляет 
 понижение температуры приведет к
понижение температуры приведет к


 при уменьшении объема газовой смеси вдвое изменится
при уменьшении объема газовой смеси вдвое изменится
 соответствующей выражению
соответствующей выражению 2)
2) 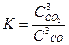 3)
3) 
 5)
5) 


 в момент равновесия концентрации равны
в момент равновесия концентрации равны 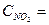 4 моль/л. Исходная концентрация
4 моль/л. Исходная концентрация 

 приведет к
приведет к ;
; при повышении давления в 2 раза увеличится в
при повышении давления в 2 раза увеличится в
 соответствует выражению
соответствует выражению 2)
2)  3)
3) 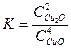
 5)
5) 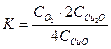
 А 5. Константа равновесия гомогенной газообразной реакции
А 5. Константа равновесия гомогенной газообразной реакции  при некоторой температуре равна 1. В состоянии равновесия концентрации веществ составили:
при некоторой температуре равна 1. В состоянии равновесия концентрации веществ составили: 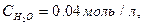
 Начальная концентрация монооксида углерода (моль/л) равна:
Начальная концентрация монооксида углерода (моль/л) равна: 1)
1) 

 2)
2) 

 3)
3) 

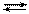 4)
4) 


 5)
5) 
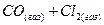
 при увеличении объема в 4 раза изменится
при увеличении объема в 4 раза изменится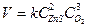 2)
2)  3)
3) 
 5)
5) 

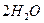
 в состоянии равновесия концентрации веществ равны
в состоянии равновесия концентрации веществ равны 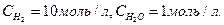 Начальная концентрация
Начальная концентрация  в
в

 приведет к
приведет к ;
; ;
;
 с 3 до 1 моль/л, изменится
с 3 до 1 моль/л, изменится
 соответствует выражению
соответствует выражению 2)
2)  3)
3) 
 5)
5) 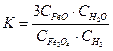


 концентрации равны
концентрации равны  Исходная концентрация
Исходная концентрация 




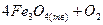 соответствует выражению
соответствует выражению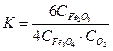 2)
2)  3)
3) 


 концентрации равны
концентрации равны  и
и  Исходная концентрация
Исходная концентрация 
 сместится вправо (→) при
сместится вправо (→) при

 при уменьшении давления смеси втрое изменится
при уменьшении давления смеси втрое изменится
 соответствует выражению
соответствует выражению 2)
2)  3)
3) 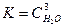
 5)
5) 


 концентрации равны
концентрации равны  и
и  Исходная концентрация
Исходная концентрация  скорость реакции возросла в
скорость реакции возросла в
 сместится влево (←) при
сместится влево (←) при концентрацию
концентрацию  увеличили от 0,02 моль/л до 0,06 моль/л, а концентрацию
увеличили от 0,02 моль/л до 0,06 моль/л, а концентрацию 

 соответствует следующему выражению
соответствует следующему выражению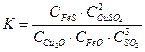 2)
2)  3)
3) 
 5)
5) 
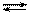
 и
и  Исходная концентрация
Исходная концентрация  скорость реакции возросла в
скорость реакции возросла в
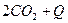 сместится влево (←) при
сместится влево (←) при


