Примеры решения задач. Пример 13.1. Сколько граммов никеля выделится на катоде при пропускании через раствор сернокислого никеля NiSO4 тока силой 5 А в течение 10 мин?
Пример 13.1. Сколько граммов никеля выделится на катоде при пропускании через раствор сернокислого никеля NiSO4 тока силой 5 А в течение 10 мин? Привести схемы электродных процессов, протекающих при электролизе с инертным анодом. Определить продукты электролиза. Решение. В водном растворе сульфат никеля (II) диссоциирует: NiSO4 = Ni2+ + SO42–. Стандартный электродный потенциал никеля (–0,250 В) выше значения потенциала восстановления ионов водорода из воды (–0,41 В). Поэтому на катоде будет происходить разряд ионов Ni2+ и выделение металлического никеля. При электролизе сернокислых солей на инертном аноде происходит электрохимическое окисление воды с выделением кислорода. Катод (−) Ni2+, Н2О Анод (+) SO42–, Н2О Ni2+ + 2ē = Ni2Н2О – 4ē = 4Н+ + О2; у анода 4Н+ + 2SO42– = 2Н2SO4. Продукты электролиза – Ni и О2. Масса вещества, выделившегося на электроде при электролизе, определяется по законам Фарадея, математическое выражение которых имеет вид
где m – масса вещества, выделившегося на электроде, г; М эк – молярная масса эквивалентов этого вещества, г/моль; Q – количество электричества, прошедшего через электролит, Кл; F – постоянная Фарадея, равная 96500 Кл/(моль∙экв). Q = I∙t, где I – сила тока, А; t – время, электролиза, с. Подставляя в формулу (1) вместо Q его значение, получаем Молярная масса эквивалентов никеля (молярная масса атомов никеля – 58,71 г/моль) равняется 58,71/2 = 29,36 г/моль. Подставляя это значение, а также силу тока и время электролиза (в секундах) в формулу (2), получаем искомую массу никеля: m = (29,36×5×600)/96500 = 0,91 г. Пример 13.2. Сколько времени нужно пропускать через раствор кислоты ток силой 10 А, чтобы получить 5,6 л водорода при нормальных условиях? Решение. Продукт электролиза представляет собой газообразное вещество, поэтому для решения воспользуемся уравнением
Так как 1 моль эквивалентов водорода занимает при нормальных условиях объем 11,2 л, то искомое количество времени прохождения тока Пример 13.3. При проведении электролиза водного раствора хлорида двухвалентного металла затрачено 3561 Кл электричества. В результате процесса на катоде выделилось 2,19 г этого металла. Определить металл, водный раствор хлорида которого подвергли электролизу. Привести схему электродных процессов. Определить продукты электролиза. Решение. Находим молярную массу эквивалентов металла: М эк Катод (−) Sn2+, Н2О Анод (+) Сl–, Н2О Sn2+ + 2ē = Sn 2Сl− – 2ē = С12. Продукты электролиза – Sn и С12. Пример 13.4. При электролизе раствора CuSO4 на угольном аноде выделилось 350 мл кислорода при нормальных условиях. Сколько граммов меди выделилось на катоде? Привести уравнения электродных процессов, определить продукты электролиза. Решение. В водном растворе сульфат меди (II) диссоциирует по схеме: CuSO4 = Cu2+ + SO42−. Электродный потенциал меди (+0,337 В) значительно больше потенциала восстановления ионов водорода из воды (–0,41 В). Поэтому на катоде происходит процесс восстановления ионов Cu2+. При электролизе водных растворов сульфат-анионы не окисляются на аноде. На нем происходит окисление воды. Катод (−) Cu2+, Н2О Анод (+) SO42–, Н2О Cu2+ + 2ē = Сu 2Н2О – 4ē = 4Н+ + О2; у анода 4Н+ + 2SO42– = 2Н2SO4. Продукты электролиза – Сu и О2. Один моль эквивалентов кислорода при нормальных условиях занимает объем 5,6 л. Следовательно, 350 мл составляют 0,35/5,6 = 0,0625 моль. Столько же молей эквивалентов выделилось на катоде. Отсюда масса меди m = Пример 13.5. Будут ли, и в какой последовательности, восстанавливаться на катоде одновременно присутствующие в растворе (в равных концентрациях) ионы А13+, Ni2+, Sn2+, Au3+ и Mg2+? Напряжение достаточно для выделения любого металла. Решение. На катоде сначала восстанавливаются катионы, имеющие большее значение электродного потенциала (табл. Б. 4). Поэтому, в первую очередь, на катоде будут восстанавливаться ионы Au3+ (+1,498 В), далее Sn2+ (–0,136 В) и, наконец, Ni2+ (–0,250 В). Ионы А13+ (–1,662 В) и Mg2+ (–2,363 В), имеющие значения электродного потенциала значительно отрицательнее потенциала восстановления ионов Н+ из воды (–0,41 В), при электролизе водных растворов не восстанавливаются на катоде. При электролизе их солей протекает восстановление молекул воды: 2Н2О + 2ē = Н2 + 2ОН–.
|

 , (1)
, (1) (2).
(2).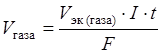 .
.
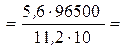 4825 c =1ч 20мин 25 с.
4825 c =1ч 20мин 25 с.
 = 59,347 г/моль. Умножая эту величину на 2 (валентность металла) получаем 118,69 г/моль, что соответствует молярной массе атомов олова. Следовательно, электролизу подвергли раствор SnCl2. В водном растворе хлорид олова (II) диссоциирует: SnС12 = Sn2+ + 2С1–. Стандартный электродный потенциал олова (II) (–0,136 В) существенно выше значения потенциала восстановления ионов водорода из воды (–0,41 В). Поэтому на катоде будет происходить разряд ионов Sn2+ и выделение металлического олова. На аноде будут окисляться анионы хлора.
= 59,347 г/моль. Умножая эту величину на 2 (валентность металла) получаем 118,69 г/моль, что соответствует молярной массе атомов олова. Следовательно, электролизу подвергли раствор SnCl2. В водном растворе хлорид олова (II) диссоциирует: SnС12 = Sn2+ + 2С1–. Стандартный электродный потенциал олова (II) (–0,136 В) существенно выше значения потенциала восстановления ионов водорода из воды (–0,41 В). Поэтому на катоде будет происходить разряд ионов Sn2+ и выделение металлического олова. На аноде будут окисляться анионы хлора.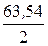 × 0,0625 = 1,98 г.
× 0,0625 = 1,98 г.


