Качественный и количественный анализ.
Белки – основа жизнедеятельности любого организма на Земле. Это сложные высокомолекулярные природные соединения. Мономерами белков являются аминокислоты. Умение определять аминокислоты важно и в теоретическом, и в практическом аспекте. Определение аминокислот сопровождается написанием уравнений качественных реакций, что способствует углублению знаний по органической химии. Это умение имеет большое значение при заболеваниях, связанных с ослаблением иммунной системы людей (аллергические заболевания, нарушение функционирования ферментативных систем и т. д.), при которых основную роль играют белки. В данной ситуации необходимо оперативно и грамотно определять аминокислоты (белки). Мы постарались в этой работе выяснить химизм качественных реакций на аминокислоты, указать роль отдельных ученых, в том числе российских, в исследовании белков, а также: 1) изучить и систематизировать имеющиеся литературные данные по качественным реакциям на белковые аминокислоты, составить базу данных о качественных, в том числе цветных, реакциях на белки; Для аминокислот, постоянно встречающихся в составе белков, разработано множество цветных (в том числе именных) реакций. Многие из них высокоспецифичны, что позволяет определять ничтожные количества той или иной аминокислоты. Надо помнить, что все качественные реакции – это реакции не собственно на белки, а на определенные аминокислоты, входящие в их состав. Основной структурной единицей белков служат a-аминокислоты. В состав большинства природных белков входит около 20 a-аминокислот. Общая формула белковых a-аминокислот:
Основным источником a-аминокислот для живого организма являются пищевые белки. Некоторые белковые аминокислоты синтезируются и самим организмом. Их называют заменимыми аминокислотами. Другие a-аминокислоты, необходимые для синтеза белков, синтезироваться в организме не могут и должны поступать только извне. Такие аминокислоты называют незаменимыми. Все a-аминокислоты, входящие в состав белков, за исключением глицина (аминоуксусная кислота), содержат один или два асимметрических атома углерода и являются оптически активными соединениями. Они существуют в виде пар зеркальных изомеров (энантиомеры, или оптические антиподы), различающихся положением аминогруппы у асимметрического (хирального) атома углерода (он обозначен звездочкой). Расположение аминогруппы справа в проекционной формуле Фишера соответствует D-конфигурации, ее расположение слева – L-конфигурации:
Большинство D-изомеров обладает сладким вкусом, а L-изомеры – горькие или безвкусные. В состав природных белков входят только L-аминокислоты. a-Аминокислоты D-ряда называют иногда неприродными, т. к. они не используются для построения белков человеческого организма. a-Аминокислоты представляют собой кристаллические вещества, растворимые в воде, имеющие сравнительно высокую температуру плавления (200–300 °С). Способность a-аминокислот растворяться в воде является важным фактором в обеспечении их биологического функционирования. С нею связана всасываемость a-аминокислот, их транспорт в организме. Такие аминокислоты имеют две ионизируемые группы: карбоксильную (–СООН) и аминогруппу (–NН2). В твердом состоянии и в водных растворах при определенных значениях рН среды a-аминокислоты существуют в виде биполярных ионов
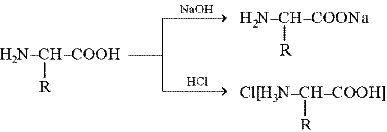
a-Аминокислоты содержат две различные функциональные группы: амино- и карбоксильную группы. Следовательно, это гетерофункциональные соединения. Аминогруппа обусловливает основные свойства вещества, а карбоксильная – кислотные, именно поэтому a-аминокислоты являются амфотерными соединениями, т. е. образуют соли как с кислотами, так и со щелочами:
Кроме того, a-аминокислоты могут вступать в другие химические реакции, характерные для амино- и карбоксильных групп. Реакция Адамкевича (Адамкевича–Гопкинса (1874)) Описание опыта. К 2 мл 1%-го раствора триптофана приливают ~1 мл концентрированной уксусной кислоты, встряхивают и по стенке пробирки осторожно добавляют ~2 мл концентрированной серной кислоты. На границе двух жидкостей наблюдают образование красно-фиолетового окрашивания. При встряхивании жидкость окрашивается в фиолетовый цвет.
|


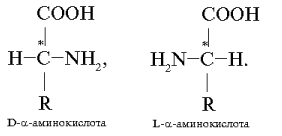
 (цвиттер-ионы), представляющих собой внутреннюю соль. В биполярном ионе карбоксильная группа диссоциирована (–СОО–), а аминогруппа протонирована
(цвиттер-ионы), представляющих собой внутреннюю соль. В биполярном ионе карбоксильная группа диссоциирована (–СОО–), а аминогруппа протонирована 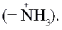 Ионизация молекул a-аминокислот зависит от рН раствора:
Ионизация молекул a-аминокислот зависит от рН раствора: