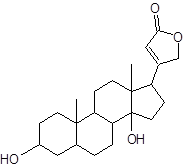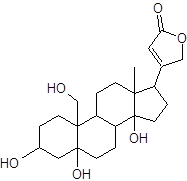Сердечные гликозиды. Введение.
Сердечными гликозидами называются гликозиды, агликоном которых являются производные циклопентанопергидрофенантрена, содержащие в положении 17 ненасыщенное пятичленное или шестичленное лактонное кольцо и оказывающие специфическое действие на сердечную мышцу. По величине лактонного цикла разной степени насыщенности они классифицируются на карденолиды и буфадиенолиды.
Кардиотоническое действие сердечных гликозидов обусловливает лактонное кольцо в С17 положении. Разрыв его или изомеризация ведет к полной потере биологической активности. В зависимости от заместителя в положении 10 карденолиды подразделяются на три подгруппы. Первая подгруппа – подгруппа наперстянки (листья наперстянки, листья наперстянки шерстистой); к ней относятся гликозиды, агликоны которых в положении 10 имеют метильную группу (‑СН3). Гликозиды этой подгруппы медленно всасываются и медленно выводятся из организма, обладают кумулятивным действием:
Дигитоксигенин
Вторая подгруппа ‑ подгруппа строфанта (семена строфанта, трава горицвета весеннего, листья ландыша, трава желтушника) включает сердечные гликозиды, агликон которых в положении 10 имеет альдегидную группу (‑COH). Эти гликозиды быстро выводятся из организма, не обладают кумулятивным действием:
Строфантидин
Третья подгруппа объединяет сердечные гликозиды, имеющие в положении 10 спиртовую группу (–СН2ОН):
Строфантидиол
Кардиостероиды в отличие от других стероидов имеют специфическую пространственную ориентацию молекулы. Относительно кольца В кольцо С всегда занимает транс-положение. Кольца С/D, в отличие других природных стероидов, всегда имеют цис-сочленение. Кольца А/В могут иметь как цис-, так и транс- пространственную ориентацию. Гликозиды с цис-сочленением колец А/В высоко активны.
Биологическая активность сердечных гликозидов зависит от числа групп –СН3 и особенно –ОН у углеродных атомов «скелета». С увеличением числа гидроксильных групп повышается полярность соединения и, естественно, растворимость в воде. По кардиотоническому действию агликоны мало отличаются от исходных сердечных гликозидов, но плохо удерживаются сердечной мышцей, быстро инактивируются в печени, поэтому действуют кратковременно и, кроме того, они токсичны (за исключением буфадиенолидов). Сердечные гликозиды можно еще классифицировать по количеству сахарных остатков в углеводной части молекулы. Их можно разделить на монозиды, биозиды, триозиды и т. д. Углеводный компонент в гликозидах присоединяется к гидроксилу в С3 стероидной части молекулы. Характерной особенностью кардиогликозидов является линейное строение углеводородной цепи. С агликонами связаны чаще всего специфические дезоксисахара (обедненные кислородом), например дигитоксоза, ацетил-дигитоксоза, цимароза и др. Концевым моносахаридом служит глюкоза. На скорость и силу кардиотонического эффекта влияет характер углеводного компонента: наиболее сильное, но кратковременное воздействие оказывают монозиды; с удлинением углеводной цепочки действие становится более мягким и длительным. 2. Физико-химические свойства. Сердечные гликозиды – бесцветные или белые кристаллические, реже аморфные, вещества без запаха, горькие на вкус, имеют определенную температуру плавления (100–270°С), оптически активны, многие из них флюоресцируют в УФ-свете. Большинство сердечных гликозидов мало растворимы в эфире диэтиловом, хлороформе, в воде, но хорошо растворяются в водных растворах метилового и этилового спиртов. Гликозиды с длинной углеводной цепью лучше растворяются в воде и водных растворах спиртов, агликоны – в органических растворителях. Сердечные гликозиды легко гидролизуются кислотами и ферментами. Мягкое ступенчатое расщепление протекает при ферментативном гидролизе:
Из первичных, нативных, гликозидов при ферментативном гидролизе образуются вторичные, которые отличаются длиной углеводной цепи. Например, при ферментативном гидролизе пурпуреагликозида А вначале образуется дигитоксин и отщепляется молекула глюкозы, а затем образуется дигитоксигенин и 3 молекулы дигитоксозы. При кислотном гидролизе сразу происходит глубокое расщепление до агликона и сахарных компонентов. В щелочной среде происходит деструкция агликона вследствие разрыва лактонного кольца, что приводит к потере кардиотонического действия. Сначала происходит образование оксикислоты, а затем образование полуацеталя и лактонизация:
3.Качественные реакции. Для обнаружения сердечных гликозидов в растительных экстрактах часто используют цветные реакции, которые разделяются на три группы: на стероидное ядро, на лактонное кольцо, на углеводную часть молекулы. Реакции на стероидное ядро. Реакции основаны на образовании сопряженных ненасыщенных систем под действием кислых реагентов (концентрированная серная кислота, ледяная уксусная кислота, уксусный ангидрид, сурьмы хлорид и др.) в неводной среде. Образуются полиены, дающие галохромные, интенсивно-окрашенные продукты, быстро изменяющие окраску во времени растворы. Реакция Либермана-Бурхарда приводит к образованию сине-зеленого окрашивания при добавлении смеси уксусного ангидрида и кислоты серной (50 частей уксусного ангидрида и 1 часть кислоты серной концентрированной). Реакция с реактивом Чугаева (хлорид цинка и ацетилхлорид в кислоте уксусной) образуется розовое окрашивание с максимумом поглощения при λ = 562 нм. Реакция Розенгейма. Карденолиды, которые содержат диеновую группу или способны ее образовывать, под действием кислоты трихлоруксусной, дают розовую окраска (λ = 562 нм), которая переходит в лиловую или синюю. Реакции на пятичленное ненасыщенное лактонное кольцо. Реакции основаны на способности пятичленного ненасыщенного лактонного кольца образовывать окрашенные комплексы в щелочной среде с различными ароматическими нитропроизводными: нитропруссидом натрия; 3-5-динитробензойной кислотой, м -динитробензолом, пикриновой кислотой. Проводят реакции с ароматическими нитропроизводными в щелочной среде: Реакция Кедде с кислотой 3,5-динитробензойной (фиолетово-красная окраска) – специфическая на γ-лактонное кольцо карденолидов; Реакция Легаля с натрия нитропруссидом (красная окраска); Реакция Раймонда с м -динитробензолом в бензоле (фиолетовая окраска); Реакция Балье с кислотой пикриновой (оранжевая окраска):
На шестичленное дважды ненасыщенное лактонное кольцо специфические реакции не найдены. Для идентификации буфадиенолидов снимают УФ-спектр, который имеет характерную полосу поглощения при длине волны 300 нм. Пятичленное лактонное кольцо в этих условиях проявляет интенсивное поглощение при 215–220 нм. Для обнаружения буфадиенолидов на хроматограммах используют 20%-ный раствор треххлористой сурьмы в хлороформе. Реакции на дезоксисахара: Реакция Келлера-Килиани со смесью двух реактивов: кислоты уксусной ледяной, содержащей следы железа (III) сульфата, и кислоты серной концентрированной со следами железа (III) хлорида (васильково-синяя окраска). Реакция с п-нитрофенилгидразином в щелочной среде. Поскольку К-строфантин и строфантозид (ди- и тригликозиды) не дают реакции Келлера-Килиани, то сначала проводят гидролиз гликозида кислотой трихлоруксусной, и свободный 2-дезоксисахар обнаруживают по голубому окрашиванию после реакции с п -нитрофенилгидразином в щелочной среде.
Хроматографическое обнаружение. В литературе описаны многочисленные системы для разделения кардиостероидов на бумаге и в тонком слое сорбента, которые можно разделить на следующие группы: 1) для слабополярных гликозидов и агликонов; 2) для полярных гликозидов и агликонов. Универсальными системами для ТСХ гликозидов является этилацетат–метанол–вода в различных соотношениях. Для обнаружения гликозидов на хроматограммах применяют реактивы, вызывающие флуоресценцию или окрашивание. Наиболее широко применяют смесь 25%-ной трихлоруксусной кислоты и 3%-ного раствора хлорамина в этиловом спирте (15:1). Хроматограммы карденолидов можно обрабатывать реактивами Кедде, Легаля, Раймонда, Балье. Универсальными реактивами для карденолидов и буфадиенолидов являются: раствор сурьмы (III) хлорида с нагреванием; смесь хлорамина с кислотой трихлоруксусной; кислота серная концентрированная с нагреванием. Реакцию Либермана–Бурхарда можно использовать для обнаружения любых стероидов, в том числе и сердечных гликозидов. В УФ свете производные дигитоксигенина дают четкую золотисто-желтую флуоресценцию; гитоксигенина – голубую; дигоксигенина – стальную.
В анализе сердечных гликозидов используют УФ-, ИК-, масс-, и ЯМР-спектроскопию. Так в УФ области спектра пятичленное лактонное кольцо вызывает интенсивное поглощение при 215 - 220 нм, а ИК область характеризуется расщепленной полосой при 1750 см-1 (‑С=О группа) и полосой при 1625 см-1 (–С=С-связь). Отсутствие строго специфических реактивов на шестичленное лактонное кольцо требует снятия для этих веществ УФ спектров, где они показывают характерную полосу поглощения при 300 нм. Поглощение в этой области использовано также для проявления хроматограммы при облучении УФ светом с длинами волн 290-360 нм. В ИК области спектра шестичленное лактонное кольце характеризуется интенсивной полосой поглощения при 1730 см-1 (С=О-группа) и двумя полосами при 1640 и 1540 см-1 (сопряженные С=С-связи). 4.Биологическое действие. Характерным признаком сердечных гликозидов является специфическое действие на сердечную мышцу: в малых дозах они усиливают ее сокращения, в больших, наоборот, угнетают работу сердца и могут вызвать его остановку. Действие сердечных гликозидов проявляется в изменении всех основных функций сердца. Механизм действия сердечных гликозидов заключается в том, что они блокируют транспортную Na+/K+-АТФ-азу мембраны кардиомиоцитов, в результате чего содержание Na+ в кардиомиоцитах возрастает, что приводит к открыванию Ca2+-каналов и вхождению Ca2+ в кардиомиоциты. Избыток Na+ приводит также к ускорению выделения Ca2+ из саркоплазматического ретикулума, таким образом внутриклеточная концентрация Ca2+ повышается, что приводит к блокаде тропонинового комплекса, оказывающего угнетающее влияние на взаимодействие актина и миозина, участвующих в сокращении гладкомышечных клеток. В результате увеличения сократимости миокарда увеличивается ударный объем крови. Под влиянием кардиогликозидов наблюдается: - усиление систолических сокращений сердца, длительность систолы уменьшается (положительное инотропное действие); - удлинение диастолы, ритм сердца замедляется, улучшается приток крови к желудочкам (отрицательное хронотропное действие); - повышение тонуса миокарда (положительное тонотропное действие); - ухудшение проводимости миокарда (отрицательное дромотропное действие); - усиление возбудимости миокарда: удлиняется промежуток между сокращениями предсердий и желудочков (положительное батмотропное действие). В диапазоне терапевтических доз возникают только первые три эффекта, именно они обусловливают клиническую ценность сердечных гликозидов. Последние два эффекта проявляются при передозировке (эффект кумуляции). Кроме кардиотонического действия сердечные гликозиды проявляют цитостатическое действие, успокаивают центральную нервную систему.
5. Список использованной литературы
1. Арзамасцев А.П. Фармакопейный анализ - М.: Медицина, 1971.
2. Глущенко Н.Н. Фармацевтическая химия: Учебник для студ. сред. проф. учеб. заведений / Н.Н. Глущенко, Т.В. Плетенева, В.А. Попков; Под ред. Т.В. Плетеневой. - М.: Издательский центр «Академия», 2004. - 384 с.
3. Логинова Н.В., Полозов Г.И. Введение в фармацевтическую химию: Учеб. пособие - Мн.: БГУ, 2003. - 250 с.
4. Мискнджьян С.П. Кравченюк Л.П. Полярография лекарственных препаратов. - К.: Вища школа, 1976. 232 с
5. Фармацевтический анализ лекарственных средств / Под общей редакцией В.А. Шаповаловой - Харьков: ИМП «Рубикон», 1995
6. Фармацевтичний аналіз: Навч. посіб. для студ. вищ. фармац. навч. закл. III-IV рівнів акредитації/П.О. Безуглий, В.О. Грудько, С.Г. Леонова та ін.; За ред. П.О. Безуглого, - X.: Вид-во НФАУ; Золоті сторінки, 2001. - 240 с.
|

 Карденолиды (листья наперстянок, трава горицвета весеннего, листья ландыша, семена строфанта, трава желтушника раскидистого, корневища с корнями кендыря коноплевого и др.)
Карденолиды (листья наперстянок, трава горицвета весеннего, листья ландыша, семена строфанта, трава желтушника раскидистого, корневища с корнями кендыря коноплевого и др.)
 Буфадиенолиды (bufo (лат.) – жаба – содержатся в яде кожных желез некоторых жаб) (корневища с корнями морозника краснеющего и кавказского, луковицы морского лука (Urginea (Scilla) maritima)
Буфадиенолиды (bufo (лат.) – жаба – содержатся в яде кожных желез некоторых жаб) (корневища с корнями морозника краснеющего и кавказского, луковицы морского лука (Urginea (Scilla) maritima)