Примеры решения задач. Задача 1. Рассчитать рН аммиачного буферного раствора, содержащего 0,02 М раствора NH4ОН и 0,2М раствора NH4Сl
Решение задач Задача 1. Рассчитать рН аммиачного буферного раствора, содержащего 0,02 М раствора NH4ОН и 0,2М раствора NH4Сl. рК(NH4ОН)=4,75, Задача 2. Можно ли приготовить аммиачный буфер с рН = 4,7, когда КД (NH4OH) = 1,8 · 10-5? Решение: 1. Определяем рК NH4OH: КД (NH4OH) = 1,8 · 10-5 рК = -ℓg КД = - ℓg 1,8 · 10-5 = -(ℓg 1,8 - ℓg 10-5) = -0,26 = 5 = 4,74. 2. Определяем интервал буферного действия по формуле: рОН = рК ± 1. рОН = 4, 74 ± 1; рН = 3,74 -5,74. Ответ: значение рОН = 4,74 входит в интервал рК 3,74 – 5,74, поэтому такой аммиачный буфер можно приготовить.
Задача 3. Для приготовления буфера взяты 70 мл 2 N р-ра NH4OH и 140 мл 0,1 N р-ра NH4С1. Как изменится рОН этого раствора, если: а) этот раствор разбавить в 10 раз, б) добавить к нему 10 мл 0,1 N р-ра NaОН? КД (NH4OH) = 1,8 · 10-5 Решение: 1. Определяем рК NH4OH: рК = -ℓg КД = - ℓg 1,8 · 10-5 = 4,74 (см. предыдущую з-чу)
2. Определяем начальное значение рОН: рОН = 4,74 + при разбавлении и добавлении NaOH рОН=4,74+ℓg 3. Определяем конечное значение рОНК после добавления NaOH: рОНК = рК +ℓg + рОНК = 4,74 +ℓg + 4. Определяем изменение рОН (ΔрОН): рОНН – рОНК = 3,74 – 3,66 = 0,08 Ответ: рОН не изменяется при разбавлении буфера в любое число раз, так как при этом не изменится соотношение концентраций компонентов буфера; ΔрОН = 0,08
Задача 4 Какова буферная ёмкость фосфатного буфера, если при добавлении 3 мл 0,01N р-ра НС1 к 20 мл этого буфера рН меняется от 7,4 до 7,1? Решение: 1. Определяем (ΔрН): Δ рН = рНН – рНК Δ рН = 7,4 – 7,1 = 0,3
2. Определяем буферную ёмкость по формуле: В =
Ответ: В = 0,005 мэ/л.
|

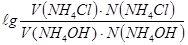
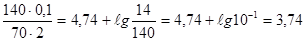
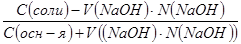 :
: ;
; ; В =
; В =