Обоснование темы.
Для живых организмов характерно поддержание кислотно-основного гомеостаза на определенном уровне. Это находит выражение в достаточно постоянных значениях рН биологических сред и способности восстанавливать нормальные значения рН при воздействии протолитов. В процессе метаболизма в организме постоянно происходит синтез, распад и взаимодействие огромного количества химических соединений. Все эти процессы осуществляются при помощи ферментов, активность которых связана с определённым значением рН. Обеспечение постоянства рН крови и других органов и тканей является одним из важнейших условий нормального существования организма. Это обеспечение достигается наличием в организме многочисленных регулирующих систем, важнейшими из которых являются буферные системы. Последние играют основную роль в поддержании КОР в организме как в условиях физиологии, так и патологии. Кроме того, материал данной темы необходим для изучения последующих тем предмета (потенциометрия, свойства растворов ВМС и т.д.) и таких дисциплин как биохимия, микробиология, гистология, гигиена, физиология, в практической деятельности врача при оценке типа и тяжести нарушений КОР.
Контрольные вопросы к теме: 1. Какие растворы называются буферными растворами? 2. Классификация буферных растворов. 3. Механизм буферного действия. 4. Уравнение Гендерсона – Гассельбаха для определения рН и рОН протолитических буферных растворов. 5. Факторы, влияющие на рН и рОН буферных растворов. 6. Буферная ёмкость. 7. Зона буферного действия. 8. Количественное определение буферной ёмкости. 9. Буферные системы крови: гидрокарбонатная, фосфатная, гемоглобиновая и протеиновая. 10. Взаимодействие буферных систем в организме. 11. Кислотно-основное равновесие. 12. Основные показатели КОР 13. Возможные причины и типы нарушений КОР организма 14. Применение реакции нейтрализации в фармакотерапии для коррекции КОР: лекарственные средства с кислотными и основными свойствами. Одним из основных свойств живых организмов является поддержание кислотно-основного гомеостаза на определенном уровне. Протолитический гомеостаз – постоянство рН биологических жидкостей, тканей и органов. Это находит выражение в достаточно постоянных значениях рН биологических сред (крови, слюны, желудочного сока и т.д.) и способности организма восстанавливать нормальные значения рН при воздействии протолитов. Система, поддерживающая протолитический гомеостаз, включает в себя не только физиологические механизмы (легочную и почечную компенсацию), но и физико-химические: буферное действие, ионный обмен и диффузию. Буферными растворами называются растворы, сохраняющие неизменными значения рН при разбавлении или добавлении небольшого количества сильной кислоты или основания. Протолитические буферные растворы представляют смеси электролитов, содержащие одноимённые ионы. Различают в основном протолитические буферные растворы двух типов: · СН3СООН + Н2О ↔ Н3О+ + СН3СОО- избыток сопряженного кислота основания СН3СООNa → Na+ + CH3COO-
· Основные, т.е. состоящие из слабого основания и избытка сопряженной с ним кислоты (т.е. соли, образованной сильной кислотой и катионом этого основания). Например: NH4OH и NH4Cl – аммиачный буфер.
NH3 + H2O ↔ OH- + NH4+ избыток Основание сопряженной NH4Cl → Cl- + NH4+ кислоты
Уравнение буферной системы рассчитывается по формуле Гендерсона-Гассельбаха: рН = рК + ℓg где рК = -ℓg КД. С – молярная или эквивалентная концентрация электролита (C = V N)
Механизм действия буферных растворов Рассмотрим его на примере ацетатного буфера: СН3СООН + СН3СООNa Высокая концентрация ацетат-ионов обусловлена полной диссоциацией сильного электролита – ацетата натрия, а уксусная кислота в присутствии одноименного аниона существует в растворе практически в неионизированном виде. 1. При добавлении небольшого количества хлороводородной кислоты, ионы Н+ связываются с имеющимся в растворе сопряженным основанием СН3СОО- в слабый электролит СН3СООН. CH3COO ‾ +H + ↔ CH3COOH (1)
Из уравнения (1) видно, что сильная кислота НС1 заменяется эквивалентным количеством слабой кислоты СН3СООН. Количество СН3СООН увеличивается и по закону разбавления В. Оствальда степень диссоциации уменьшается. В результате этого концентрация ионов Н+ в буфере увеличивается, но очень незначительно. рН сохраняется постоянным. При добавлении кислоты к буферу рН определяется по формуле: рН = рК + ℓg
2. При добавлении к буферу небольшого количества щелочи протекает реакция её с СН3СООН. Молекулы уксусной кислоты будут реагировать с гидроксид-ионами с образованием Н2О и СН3СОО ‾: CH3COOН + OH ‾ ↔ CH3COO ‾ + H2O (2)
В результате этого щелочь заменяется эквивалентным количеством слабоосновной соли CH3COONa. Количество СН3СООН убывает и по закону разбавления В.Оствальда степень диссоциации увеличивается за счет потенциальной кислотности оставшихся недиссоциированных молекул СН3СООН. Следовательно, концентрация ионов Н+ практически не изменяется. рН остаётся постоянным. При добавлении щелочи рН определяется по формуле: рН = рК + ℓg 3. При разбавлении буфера рН также не меняется, т.к. константа диссоциации и соотношение компонентов при этом остаются неизменными. Таким образом, рН буфера зависит от: константы диссоциации и соотношения концентрации компонентов. Чем эти величины больше, тем больше рН буфера. рН буфера будет наибольшим при соотношении компонентов равным единице.
Значения рН различных биологических жидкостей и тканей организма.
Для количественной характеристики буфера вводится понятие буферной ёмкости.
|

 Кислотные т.е. состоящие из слабой кислоты и избытка сопряженного с ней основания (соли, образованной сильным основанием и анионом этой кислоты). Например: СН3СООН и СН3СООNa - ацетатный буфер
Кислотные т.е. состоящие из слабой кислоты и избытка сопряженного с ней основания (соли, образованной сильным основанием и анионом этой кислоты). Например: СН3СООН и СН3СООNa - ацетатный буфер
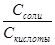 , pOH = pK + ℓg
, pOH = pK + ℓg  ,
,




